| ISO 9000 | ISO 14000 |
 GMP Consulting |
|
МИНИСТЕРСТВО ОХРАНЫ ЗДОРОВЬЯ УКРАИНЫ ГОСУДАРСТВЕННЫЙ ДЕПАРТАМЕНТ ПО КОНТРОЛЮ НАД КАЧЕСТВОМ, БЕЗОПАСНОСТЬЮ И ПРОИЗВОДСТВОМ ЛЕКАРСТВЕННЫХ СРЕДСТВ И ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ ГОСУДАРСТВЕННЫЙ НАУЧНЫЙ ЦЕНТР ЛЕКАРСТВЕННЫХ СРЕДСТВ МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИПО ВЫПОЛНЕНИЮ САНИТАРНО-ГИГИЕНИЧЕСКИХ ТРЕБОВАНИЙ И ПРОВЕДЕНИЯ МИКРОБИОЛОГИЧЕСКОГО КОНТРОЛЯ В ПРОИЗВОДСТВЕ НЕСТЕРИЛЬНЫХ ЛЕКАРСТВЕННЫХ СРЕДСВ
МИНИСТЕРСТВО ОХРАНИ ЗДОРОВЬЯ УКРАИНЫПРИКАЗ14.12.2001 г. г.Киев №502 Об утверждении методических рекомендаций по выполнению санитарно-гигиенических требований и проведения микробиологического контроля в производстве нестерильных лекарственных средствС целью обеспечения надлежащего качества лекарственных средств в соответствии с приложением 4 Комплексной программы развития медицинской промышленности в период 1997-2003 годов, утвержденной постановлением Кабинета Министров Украины от 18 декабря 1996 года №1538, ПРИКАЗЫВАЮ: 1.Утвердить методические рекомендации по выполнению санитарно-гигиенических требований и проведения микробиологического контроля в производстве нестерильных лекарственных средств:1.1.Методические рекомендации по классификации производственных помещений по допустимому содержанию микроорганизмов и частиц в воздухе (прилагаются). 1.2.Методические рекомендации по подготовке вентиляционного воздуха для производственных помещений (прилагаются). 1.3.Методические рекомендации по подготовке производственных помещений (прилагаются). 1.4.Методические рекомендации по подготовке технологического оборудования (прилагаются). 1.5.Методические рекомендации по подготовке одежды персонала, который работает в производственных помещений (прилагаются). 1.6.Методические рекомендации по обработке рук персонала, который работает в производственных помещений (прилагаются). 1.7.Методические рекомендации по подготовке к работе и правил поведения персонала (прилагаются). 1.8.Методические рекомендации по подготовке материалов для первичной упаковки (прилагаются). 1.9.Методические рекомендации по контролю содержания микроорганизмов и частиц в воздухе производственных помещений (прилагаются). 1.10.Методические рекомендации по контролю микробиологической чистоты поверхностей производственных помещений (прилагаются). 1.11.Методические рекомендации по контролю микробиологической чистоты технологического оборудования и инвентаря (прилагаются). 1.12.Методические рекомендации по контролю микробиологической чистоты одежды персонала, который работает в производственных помещений (прилагаются). 1.13.Методические рекомендации по контролю микробиологической чистоты рук персонала, который работает в производственных помещений (прилагаются). 1.14.Методические рекомендации по контролю микробиологической чистоты материалов для первичной упаковки (прилагаются). 1.15.Методические рекомендации по приготовлению и применения рабочих растворов для моющих, дезинфекционных, моюще-дезинфекционных средств и антисептиков (прилагаются). 1.16.Методические рекомендации по порядку поступления исходящего сырья и материалов для первичной упаковки на склад предприятия и на производство нестерильных лекарственных средств (прилагаются). 1.17.Методические рекомендации по хранению исходящего сырья и материалов для первичной упаковки (прилагаются). 2.Директору Государственного научного центра лекарственных средств Георгиевскому В.П. обеспечить публикацию этого приказа в средствах массовой информации. 3.Считать такими, что не применяются на территории Украины: «Инструкция. Соблюдение и контроль личной гигиены персонала производственных помещений на предприятиях и в организациях химико-фармацевтической промышленности (РДИ 64-28-84)»; «Инструкция. Порядок подготовки отбора проб и определение микробной обсемененности воздуха, аппаратуры и коммуникаций производственных помещений на предприятиях и в организациях химико-фармацевтической промышленности (РДИ 64-29-84)»; «Инструкция. Требования по предупреждению микробной загрязненности продукции в процессе производства нестерильных лекарственных средств на предприятиях и в организациях химико-фармацевтической промышленности (РДИ 64-30-84)»; «Инструкция. Требования к условиям хранения и транспортировке лекарственных средств и тароупаковочных материалов на предприятиях и в организациях химико-фармацевтической промышленности (РДИ 64-31-84)», утвержденных Приказом Министерства медицинской промышленности СССР от 1 августа 1984 года №391 и «Инструкция. Классификация помещений для производства нестерильных лекарственных средств по содержанию 4 микроорганизмов в воздухе (РДИ 64-029-87)», утвержденной и введенную в действие Указом Министерства медицинской и микробиологической промышленности СССР от 27 марта 1987 года №02-31/68. 4.Контроль по выполнению этого приказа положить на заместителя Государственного секретаря, председателя Государственного департамента по контролю за качеством, безопасностью и производством лекарственных средств и изделий медицинского назначения Коротка О.Ш.Министр В.Ф.Москаленко СОДЕРЖАНИЕВступление……………………………………………………………………………………………………….3 Методические рекомендации по классификации производственных помещений по допустимому содержанию микроорганизмов и частиц в воздухе…………………………………..……7 Методические рекомендации по подготовке вентиляционного воздуха для производственных помещений……………………………………………………………...……...………….10 Методические рекомендации по подготовке производственных помещений………………………...……13 Методические рекомендации по подготовке технологического оборудования………………………...….16 Методические рекомендации касательно подготовки одежды персонала, который работает в производственных помещений……………………………………………………….....18 Методические рекомендации по обработке рук персонала, который работает в производственных помещений……………………………………………………….…21 Методические рекомендации по подготовке к работе и правил поведения персонала………………...….23 Методические рекомендации по подготовке материалов для первичной упаковки………………...……..29 Методические рекомендации по контролю содержания микроорганизмов и частиц в воздухе производственных помещений………………………………………………………………….....33 Методические рекомендации по контролю микробиологической чистоты поверхностей производственных помещений………………………………………………………………...41 Методические рекомендации по контролю микробиологической чистоты технологического оборудования и инвентаря………………………………………………………………...46 Методические рекомендации по контролю микробиологической чистоты одежды персонала, который работает в производственных помещений……………………………………………..50 Методические рекомендации по контролю микробиологической чистоты рук персонала, который работает в производственных помещений……………………………………………..54 Методические рекомендации по контролю микробиологической чистоты материалов для первичной упаковки……………………………………………………………………………………….58 Методические рекомендации по приготовлению и применения рабочих растворов для моющих, дезинфекционных, моюще-дезинфекционных средств и антисептиков……………………...63 Методические рекомендации по порядку поступления исходящего сырья и материалов для первичной упаковки на склад предприятия и на производство нестерильных лекарственных средств………………………………………………………………………...90 Методические рекомендации по хранению исходящего сырья и материалов для первичной упаковки………………………………………………………………………………………..94 6 УТВЕРЖДЕНОПриказ МОЗ Украины 14.12.2001 г. № 502 МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИПО КЛАССИФИКАЦИИ ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЙ НЕСТЕРИЛЬНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПО ДОПУСТИМОМУ СОДЕРЖАНИЮ МИКРООРГАНИЗМОВ И ЧАСТИЦ В ВОЗДУХЕ 1. Общие положения 1.1 .В этих методических рекомендациях приведена классификация помещений для производства нестерильных лекарственных средств в зависимости от содержания аэрозольных частиц и микроорганизмов. 1.2 .Класс чистоты помещения определяют по содержанию частиц размером 0,5 мкм и более и жизнеспособных микроорганизмов в 1м3 воздуха. 1.3 .Помещение необходимо классифицировать в соответствии от вида лекарственных форм, что производятся, стадии производственного процесса и требований к конкретным лекарственным средствам. 1.4 .Производитель самостоятельно определяет уровень чистоты воздушной среды производственных помещений (рабочих зон) при валидации технологического процесса. При строительстве новых или реконструкции существующих производств классы чистоты необходимо предвидеть на первых стадиях разработки проектной документации. 1.5 .Требования к уровню чистоты воздушной среды зависит от того в каком состоянии находится производственное помещение: «оснащенном» или «функционирующем». 1.6 .«Оснащенное» состояние – это условие, при котором система чистого помещения, производственное оборудование полностью установленные и готовые к работе, но персонал отсутствует. 1.7 .«Функционирующее» состояние – это условие, при котором система чистого помещения и оборудование функционируют в установленном режиме с определенным количеством работающего персонала. 2. Классификация производственных помещений 2.1 .Производство нестерильных лекарственных средств рекомендуется осуществлять в помещениях классов чистоты C и D. Допускается осуществлять производство нестерильных лекарственных средств в помещениях, в которых не приводится контроль на содержание частиц и микроорганизмов, при условии отсутствия контакта открытой продукции с окружающей средой. 2.2 .Максимально допустимый уровень содержания частиц и микроорганизмов в воздухе производственных помещений в соответствии к классам чистоты приведенной в Таблице 1: - нормативы по содержанию частиц в воздухе должны придерживаться во всем помещении, когда оно находится в оснащенном состоянии; - максимально допустимое количество жизнеспособных микроорганизмов должно отвечать нормативным требованиям в воздухе рабочей зоны, когда помещение находится в функционирующем состоянии. 2.3 .Максимально допустимое количество частиц в воздухе рабочей зоны в функционирующем состоянии производственных помещений приведена в Таблице 2. 2.4 .Если характер технологического процесса и вид лекарственной формы, что производится, не позволяет обеспечить класс чистоты за максимально допустимое количество частиц, то в производстве таких нестерильных лекарственных средств допускается устанавливать класс чистоты только за количество жизнедеятельных микроорганизмов в 1м3 воздуха. 2.5 .Технологические операции, которые есть наиболее критичными с точки зрения возможного загрязнения микроорганизмами, рекомендуется проводить в зонах, соответствующих классу чистоты С. 2.6 .Должны быть предусмотрены помещения (зоны) соответствующего класса чистоты для сушки и термической обработки одежды, и подготовки персонала. 2.7 .Помещение этикетирования и оформление готовой продукции, хранение готовых лекарственных средств, вспомогательных веществ и субстанций, стирка одежды для работающих в производственных помещениях допускается не контролировать на содержание частиц и микроорганизмов в воздухе. Таблица 1. Классификация помещений производства нестерильных лекарственных средств по максимально допустимому количеству частиц и микроорганизмов в воздухе
* - в помещениях D класса чистоты максимальное допустимое количество жизнедеятельных микроорганизмов в воздухе может составлять 500 КУО/м3, если в процессе валидации будет доказаноЮ что при этом не происходит ухудшения качества лекарственного средства по показателям «микробиологическая чистота». 8 Таблица 2. Максимально допустимое количество частиц в воздухе рабочей зоны во время технологического процесса.
* - требования к этим зонам устанавливается производителем при валидации технологического процесса. Директор ГНЦЛС, Академик МИА В.П. Георгиевский 9 УТВЕРЖДЕНОПриказ МОЗ Украины 14.12.2001 г. № 502 МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИПО ПОДГОТОВКЕ ВЕНТИЛЯЦИОННОГО ВОЗДУХА ДЛЯ ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЙ 1. Общие положения 1.1.Эти методические рекомендации предлагают порядок подготовки вентиляционного воздуха, что поступает в помещения производства нестерильных лекарственных средств. 1.2 .Как вентиляционный воздух понимают воздух, очищенный от частиц и микроорганизмов в системе подготовки дву- или трехступенчатой фильтрации, который поступает в помещения производства нестерильных лекарственных средств. 1.3 .Производственные помещения должны иметь эффективную систему приточно-вытяжной вентиляции. 1.4 .Систему подготовки вентиляционного воздуха следует проектировать, исходя из специальных требований к технологическим операциям, требований к помещениям производства нестерильных лекарственных средств соответственно с приведенной классификации в Методических рекомендациях по классификации производственных помещений нестерильных лекарственных средств по допустимому содержанию микроорганизмов и частиц в воздухе, утвержденных приказом МОЗ Украины от 14.12.2001 г., № 502, руководствуясь отраслевыми документами, в частности ГП 07.004.98, ГНД 07.006.98, МВГ 07.003.987, а также ГНД 01.001.98. 2. Подготовка вентиляционного воздуха 2.1.При определении места забора наружного воздуха необходимо учитывать существующие и возможные источники аэрозольных и газообразных загрязнений (дымоходы, автотранспорт, газообразные производственные выбросы, цветущие растения и т.д.). 2.2.В системе подачи вентиляционного воздуха в производственные помещения C и D классов чистоты применяется не однонаправленный воздушный поток. 2.3.Рассчетную производительность систем вентиляции и кондиционирования воздуха следует определять исходя из условий, необходимых для обеспечения нужных параметров: скорости потока воздуха, чистоты воздуха, влажности и температуры в рабочей зоне с учетом принятой схемы организации воздухообмена. 2.4.Необходимые параметры температуры и влажности должны обеспечиваться системами кондиционирования воздуха. 2.5.Системы вентиляции и кондиционирования воздуха должны быть оборудованы шумопоглощающими и антивибрационными приспособлениями, что снижают уровень шума и вибрации до заданных пределов, автоматическим регулированием температуры и влажности, блокировкой, сигнализацией. 2.6.Рекомендуется использовать рециркуляцию воздуха, кроме технически обоснованных случаев, которые учитывают токсичность и взрывоопасность материалов и технологических сред, которые применяются. 2.7.Воздуховоды следует периодически чистить и проводить их дезинфекционную обработку. Воздуховоды, фильтровальные камеры и их конструкции должны быть изготовлены с материала, устойчивому к дезинфицирующим растворам. Обработка воздуховодов дезинфицирующими растворами обязательна для производственных помещений, что подлежат контролю на содержание микроорганизмов в воздухе. 2.8.Очистка приточного воздуха должна быть ступенчатой. Количество уровней очистки обуславливается необходимой чистотой воздушной среды помещений. 2.9.Очистка воздуха в производственные помещения C и D классов чистоты должна быть трехступенчатой. На каждом уровне очистки следует использовать фильтры, что по эффективности фильтрации соответствуют требованиям европейским стандартам EN 779 и EN 1822. 2.10.На каждом уровне фильтры должны соответствовать следующим классам: - для производственных помещений C класса чистоты: 1 уровень – не ниже класса G4 2 уровень – не ниже класса F7 3 уровень – не ниже класса H12 - для производственных помещений D класса чистоты: 1 уровень – не ниже класса G3 2 уровень – не ниже класса F6 3 уровень – не ниже класса H11 2.11.На каждом уровне очистки следует предусмотреть штуцеры с целью отбора проб воздуха для определения концентрации механических частиц до и после фильтрации. 2.12.Замена фильтра тонкой очистки производится по мере его засорения относительно данных дифференциального манометра, который измеряет разницу давления воздуха, что поступает на фильтр и что выходит после фильтрации. 2.13.После замены высокоэффективного фильтра следует произвести проверку воздушной среды на соответствие установленного класса чистоты для данного производственного помещения. 2.14.Кратность воздухообмена в производственные помещения C и D классов чистоты следует определять с учетом особенностей технологического процесса, размеров помещения, оборудования, которое находится в нем и количества персонала. Конкретную цифру для каждого производственного помещения определяют путем расчетов на этапе его проектирования. 2.15.Комфортную температуру в производственные помещения следует поддерживать на уровне (21±2) °С зимой и (23±2) °С летом, относительную влажность воздуха - в пределах от 30 до 50 % с учетом технологических требований. В производственных помещениях, в которых не проводится контроль на содержание частиц и микроорганизмов в воздушной среде, относительная влажность воздуха должна составлять от 40 до 60 % Директор ГНЦЛС, Академик МИА В.П. Георгиевский УТВЕРЖДЕНОПриказ МОЗ Украины 14.12.2001 г. № 502 МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИПО ПОДГОТОВКЕ ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЙ 1. Общие положения 1.1 Эти методические рекомендации предлагают порядок подготовки к работе помещений, которых осуществляют производство нестерильных лекарственных средств. 1.2 Подготовка производственных помещений это комплекс мероприятий, который состоит из влажной уборки, дезинфекционной обработки, возможного ультрафиолетового облучения поверхностей помещений, выполнение которых направлено на достижение соответственного класса чистоты. 1.3 Подготовка производственных помещений делится на ежедневную, еженедельную, ежемесячную, полугодичную и годичную. 1.4 Подготовку производственных помещений следует проводить в одежде, предусмотренной для производственных помещений того же класса чистоты и, при необходимости, в респираторе. Дезинфекционная обработка производственных помещений, в которых не проводится контроль микробиологической чистоты, не обязательна. 1.5 Подготовку производственных помещений проводят соответственно требованиям стандартных рабочих процедур предприятия. Процедура подготовки производственных помещений должна пройти валидацию. 1.6 Контроль микробиологической чистоты поверхностей производственных помещений проводят соответственно требованиям Методических рекомендаций по контролю микробиологической чистоты поверхностей производственных помещений, утвержденных приказом МОЗ Украины от 14.12.2001 г., № 502. 2. Материалы для уборки и дезинфекционной обработки 2.1 Моющие и дезинфекционные средства и их концентрации в рабочих растворах, которые следует использовать для санитарной подготовки помещений, приведены в Методических рекомендациях по приготовлению и применению рабочих растворов моющих, дезинфекционных, моюще-дезинфекционных средств и антисептиков, утвержденных приказом МОЗ Украины от 14.12.2001 г., № 502. 2.2 Для протирания потолка, стен, дверей, окон, рабочих столов и других поверхностей рекомендуется использовать поролоновые губки или салфетки из синтетических материалов, которые сделаны из безворсовой ткани с подвернутыми краями (арт. 56003;56020;56326) ГОСТ 16428-89. Для мытья пола следует использовать тряпки с грубых тканей с подвернутыми краями, светлых тонов (арт. 6312; 6854; 6914; 6927) ГОСТ 5530-81. 2.3 Для использования материалов, которые не указаны в списке разрешенных в Украине материалов для уборки производственных помещений на предприятиях фармацевтической промышленности, необходимо иметь разрешение уполномоченных органов. 2.4 Материалы и инвентарь для уборки производственных помещений (тряпки, ведра, швабры и др.) следует маркировать, сохранять в специальном помещении и использовать по назначению. Не допускается использование деревянного инвентаря. 2.5 Влажную обработку поверхностей помещений проводят теплой (45±5) °С водопроводной водой с моющими средствами. 2.6 После влажной обработки проводят обработку дезинфекционными растворами. 2.7 Материалы для уборки производственных помещений после использования стирают в растворе теплой водопроводной воды с моющими средствами, потом споласкивают в чистой водопроводной воде и высушивают в назначенном месте. Высушенные материалы складывают в специально отведенных для этого помещениях. Перед использованием их обеззараживают в растворе дезинфекционного средства. 3. Ежедневная подготовка 3.1 Подготовку помещений проводят после каждой смены в следующей последовательности: - в процессе работы в случае необходимости удаляют производственные отходы; - убирают рассыпанные порошки и другие вещества и механические загрязнения с помощью пылесоса, вытирают пролитые жидкости, а в случае необходимости, применяют средства для обезжиривания; - вносят в помещение необходимый уборочный инвентарь, материалы и теплую воду с моющим средством в количестве, которое необходимо для одной уборки; - проводят влажную уборку: потолок (в случае необходимости), стены, двери, столы и другие поверхности помещения моют поролоновой губкой, которая хорошо смочена раствором моющего средства, с расчета 100-150 мл/м2, потом промывают теплой водой, высушивают или вытирают досуха и проводят дезобработку; - проводят подготовку технологического оборудования и инвентаря соответственно требованиям Методических рекомендаций по подготовке технологического оборудования, утвержденных приказом МОЗ Украины 14.12.2001 г. № 502.; - моют пол теплой водой с моющим средством, потом промывают теплой водой, вытирают досуха и проводят дезобработку, каждый раз начиная с отдаленной от двери площади. 3.2 Мыть поверхности следует постепенными движениями, захватывая каждый раз 1/3 части ранее протертой площади. 3.3 Во время уборки запрещается добавлять свежие растворы в такие же растворы, которые используются для мытья или дезинфекционной обработки. 3.4 В случае использования ультрафиолетового излучения, помещения освобождают от персонала, потом включают бактерицидные лампы на 1,5-2 часа. Продолжительность работы каждой бактерицидной лампы регистрируют в специальном журнале. 3.5 После окончания подготовки помещения оформляют соответствующий протокол, который подписывается ответственными лицами за санитарно-гигиеническое состояние этого помещения. Качество подготовки помещения контролируется представителем отдела контроля качества. 3.6 Помещения маркируют, указывая его готовность к работе. 4. Еженедельная подготовка. 4.1 Проводят мытье потолка, дезинфекционную обработку пола всего участка, очистка и дезинфекционная обработка канализационной системы, а также выполняют все меры ежедневной подготовки. 5. Ежемесячная подготовка помещений 5.1 Проводят уборку и наведение порядка в шкафах, стеллажах, очистку и дезинфекционную обработку воздушной техники, а также выполняют все меры еженедельной подготовки помещений. 6. Полугодичная подготовка помещений 6.1 Проводят очистку осветительного оборудования, внешних поверхностей окон, очистку и дезинфекционную обработку воздушной техники, а также выполняют все меры ежемесячной подготовки помещений. 7. Годовая подготовка помещений 7.1 Проводят плановые ремонтные и слесарные работы, а также выполняют все меры полугодовой подготовки помещений. Директор ГНЦЛС, академик МИА В.П. Георгиевский 15 УТВЕРЖДЕНОПриказ МОЗ Украины 14.12..2001 г. № 502 МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПОДГОТОВКЕ ТЕХНОЛОГИЧЕСКОГО ОБОРУДОВАНИЯ 1. Общие положения 1.1 Эти методические рекомендации предлагают порядок подготовки к работе технологического оборудования (дальше оборудования), которое используется в производстве нестерильных лекарственных средств. 1.2 Под подготовкой оборудования подразумевают очистку, мытьё и дезинфекционную обработку внутренних и внешних его поверхностей. 1.3 Подготовку оборудования проводят перед началом или после окончания технологической операции, или в конце смены. 1.4 Подготовку оборудования следует проводить в специальной одежде, предназначенной для работы в производственных помещениях соответственного класса чистоты и, при необходимости, в респираторе. 1.5 Подготовку оборудования проводят в соответствии со стандартными рабочими процедурами предприятия. Процедура подготовки оборудования должна пройти валидацию. 1.6 Контроль микробиологической чистоты оборудования и инвентаря, который используется для подготовки оборудования, проводят соответственно требованиям Методичных рекомендаций по контролю микробиологической чистоты технологического оборудования и инвентарю, утвержденный приказом МОЗ Украины 14.12.2002 г. №502. 2. Средства и материалы для подготовки оборудования. 2.1 Моющие и дезинфекционные средства и их концентрации в рабочих растворах для подготовки оборудования приведены в Методичных рекомендациях по приготовлению и использованию моющих, дезинфицирующих, моюще-дезинфицирующих средств и антисептиков, утвержденных приказом МОЗ Украины 14.12.2002 г. №502. 2.2 Для обработки оборудования рекомендуется использовать поролоновые губки или салфетки из безворсовой ткани с заложенными краями. При необходимости следует применять щетки или лопатки из синтетических материалов, а также применять пылесос. 2.3 Материалы и инвентарь для подготовки оборудования необходимо маркировать, сохранять в специальном помещении и использовать только по назначению. 2.4 После использования материалы стирают, а инвентарь моют в растворе теплой воды с моющим средством, потом прополаскивают в чистой водопроводной воде, высушивают в специально предназначенном для этого месте. 2.5 Перед использованием материалы и инвентарь обеззараживают в растворе дезинфицирующего средства. 3. Подготовка технологического оборудования 3.1 Перед началом подготовки отключают от электрического тока оборудование и электроприборы. 3.2 Удаляют при помощи щеток, лопаток, пылесоса или влажной салфетки механическое загрязнение или пыль с внешних и внутренних поверхностей оборудования. Жидкости вытирают, а при необходимости используют средства для обезжиривания. 3.3 Оборудование моют сначала теплой водой (45 ±5)ºС с моющим средством, потом промывают водой очищенной и высушивают или вытирают досуха. 3.4 Проводят дезинфекционную обработку, протирая поверхности дезинфицирующим раствором или выдерживая в нем. 3.5 После дезинфицирующей обработки оборудование промывают горячей водой очищенной. 3.6 Проводят контроль полноты отмывания технологического оборудования от дезинфицирующего средства согласно требованиям Методических рекомендаций по приготовлению и применению моющих, дезинфицирующих, моюще-дезинфицирующих средств и антисептиков, утвержденных приказом МОЗ Украины 14.12.2002 г. №502. 3.7 Периодичность контроля полноты отмывания технологического оборудования от дезинфицирующего средства определяется производителем при валидации процесса отмывания. 3.8 При обработке спиртом этиловым 76% оборудование не подлежит дальнейшему промыванию водой. 3.9 В случае беспрерывного выпуска лекарственного средства, чувствительного к микробиологическому загрязнению, необходимо периодически проводить очистку, мытье и дезинфицирующую обработку оборудования. Периодичность такой обработки определяет производитель при валидации технологического процесса. 3.10 После окончания подготовки оборудования оформляют соответственный протокол, который подписывается ответственными лицами за подготовку этого оборудования. Качество подготовки оборудования контролируется представителем отдела контроля качества. 3.11 Оборудование маркируют, указывая его готовность к работе. 3.12 Сохранять оборудование необходимо в чистом и сухом состоянии. Директор ГНЦЛС, Академик МИА В.П. Георгиевский 17 УТВЕРЖДЕНО Приказ МОЗ Украины 14.12.2001 г. № 502 МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПОДГОТОВКЕ ОДЕЖДЫ ПЕРСОНАЛА, КОТОРЫЙ РАБОТАЕТ В ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЯХ 1. Общие положения 1.1 Эти методические рекомендации предлагают порядок подготовки одежды, которая используется персоналом в производстве нестерильных лекарственных средств (дальше - одежда), способы ее обработки и деконтаминации. 1.2 Под комплектом одежды подразумевают комплект, который предназначен для защиты материалов, полупродуктов или готовой продукции от повторной контаминации микроорганизмами или частицами, которые выделяются персоналом. 1.3 Подготовка комплекта одежды состоит с осмотра перед стиркой, стирки, сушки, термической обработки (в паровом стерилизаторе или глаженье) одежды; мытья, сушки и термической обработки перчаток; влажной и дезинфекционной обработки обуви. 1.4 Комплект одежды, предназначенный для работы в помещениях производства нестерильных лекарственных средств, должен соответствовать требованиям ГСТУ 64-9-2000 «Должная производственная практика. Комплект одежды для работающих в чистых помещениях производств медицинской и микробиологической промышленности. Виды и комплектность». 1.5 Комплект одежды может быть как одноразового, так и многоразового использования. 1.6 Смену комплекта одежды следует проводить согласно требованиям ГСТУ 64-9-2000 «Должная производственная практика. Комплект одежды для работающих в чистых помещениях производств медицинской и микробиологической промышленности. Виды и комплектность». 1.7 Комплект одежды, предназначенный для работы в определенной зоне производственного помещения, может быть использован только в этой зоне и должен иметь соответствующую метку. 1.8 Сушку и глаженье одежды, и сушку перчаток рекомендуется проводить в специально предназначенном изолированном помещении, класс чистоты которого должен быть не ниже класса чистоты производственного помещения, в котором они будут использоваться. 1.9 Персонал, который осуществляет сушку и глаженье одежды и сушку перчаток, должен работать в подготовленной одежде соответствующего класса чистоты. 1.10 Персонал, который осуществляет подготовку одежды, перчаток, и обуви должен быть ознакомлен с соответствующими стандартными рабочими процедурами. 1.11 Специально выделенный работник должен разложить подготовленные комплекты одежды в индивидуальные отделения шкафов или стеллажей. 1.12 Контроль микробиологической чистоты одежды проводят согласно требованиям Методических рекомендаций по контролю микробиологической чистоты одежды персонала, работающего в производственных помещениях, утвержденных приказом МОЗ Украины 14.12.2001 г. № 502. 2 Подготовка одежды 2.1 Осмотр одежды. 2.1.1 Перед стиркой необходимо провести осмотр состояния одежды с целью оценки степени его износа, выявления повреждений, проверки работы застежек и разделения по цветам и принадлежностью. При наличии дефектов одежду ремонтируют или меняют на новую. 2.1.2 Одежду, предназначенную для работы в помещениях разных классов чистоты, следует осматривать и сохранять до стирки отдельно. 2.1.3 При осмотре одежду следует застегнуть на застежки. 2.1.4 Перед отправкой на стирку или ремонт одежду следует сохранять в закрытых биксах или контейнерах. 2.1.5 Одежда работающих с живыми культурами микроорганизмов до стирки необходимо подвергнуть соответствующей дезинфекционной обработке. 2.2 Стирка, сушка, термическая обработка и упаковка одежды. 2.2.1 Стирка, сушка, термическая обработка и упаковка одежды, предназначенной для работы в помещениях разных классов чистоты, необходимо проводить отдельно. 2.2.2 На каждый килограмм одежды следует использовать не менее 10 л раствора моющего средства. 2.2.3 Для стирки следует использовать синтетические моющие средства, согласно соответственно требованиям ГСТУ 64-8-2000 «Должная производственная практика. Комплект одежды для работающих в чистых помещениях производств медицинской и микробиологической промышленности. Общие технические требования». 2.2.4 Температуру стирки устанавливают соответственно требованиям нормативной документации на ткань. 2.2.5 Продолжительность стирки зависит от технических характеристик стиральной машины. 2.2.6 После окончания стирки необходимо прополоскать одежду не менее двух раз в теплой воде. Окончательное споласкивание проводят в холодной воде. 2.2.7 Одежду необходимо отжать в центрифуге, после чего струсить и развесить по комплектам на плечиках и высушить. Сушить его следует в специальном шкафу, в который поступает воздух через фильтр тонкой очистки. 2.2.8 Каждый комплект одежды поддают термической обработке в паровом стерилизаторе, соответственно требованиям ГСТУ 64-8-2000 «Должная производственная практика. Комплект одежды для работающих в чистых помещениях производств медицинской и микробиологической промышленности. Общие технические требования», или гладят с лицевой стороны, используя утюг или гладильный пресс. Температура для глажения должна быть максимально допустимой для каждого типа ткани. 2.2.9 Подготовленная одежда для чистых помещений складывают в мешочки из безворсовой ткани, которые прошли подготовку вместе с одеждой, которые завязывают лентой, или в новые полиэтиленовые пакеты, которые термически запаивают. Упакованную одежду складывают в защитные контейнеры. 2.3 Мытье, сушка, и термическая обработка перчаток. 2.3.1 Внешнюю и внутреннюю части перчаток следует тщательно вымыть теплой водопроводной водой с 70 % хозяйственным мылом, прополоскать водой очищенной и высушить. 2.3.2 Сушку перчаток следует проводить в сушильном шкафу при температуре (65 ± 5)ºС на протяжении 10-15 минут с двух сторон, положив перчатки в один ряд. 2.3.3 Высушенные перчатки следует свернуть парами в два слоя растительного пергамента или поместить в мешочки из безворсовой ткани, а потом снова завернуть в один слой пергамента. Свертки поместить (не уплотняя) в биксы или другие контейнеры, которые закрываются крышками, и передать на термическую обработку в паровой стерилизатор. 2.3.4 Стерильную обработку перчаток следует проводить в паровом стерилизаторе при избыточном давлении 0,11 Мпа (1,1 кгс/см2) и температуре (120±1) ºС на протяжении 45 мин. После окончания процесса термической обработки необходимо спустить пар и подсушить перчатки. 2.3.5 После окончания процесса термической обработки комплекты перчаток передают в гардеробную подготовки персонала. 2.4 Подготовка обуви, которая используется в производственных помещениях. 2.4.1 Не реже одного раза в неделю следует проводить влажную обработку обуви в следующей последовательности: - помыть 0,5 % раствором моющего средства; - прополоскать водой очищенной; - провести дезинфекционную обработку; - прополоскать водой очищенной; - высушить. 2.4.2 Допускается проводить обработку обуви моюще-дизинфекционным раствором. После такой обработки обувь следует прополоскать водой очищенной, а потом высушить. Директор ГНЦЛС, Академик МИА В.П. Георгиевский УТВЕРЖДЕНО Приказ МОЗ Украины 14.12.2001 г. № 502 МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОБРАБОТКЕ РУК ПЕРСОНАЛА, КОТОРЫЙ РАБОТАЕТ В ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЯХ 1. Общие положения 1.1 Эти методические рекомендации предлагают порядок обработки рук персонала, который работает в производственных помещениях нестерильных лекарственных средств. 1.2 Антисептики, которые применяются для обработки рук персонала, приведены в Методических рекомендациях по приготовления и применению рабочих растворов моющих , дезинфекционных, моюще-дезинффекционных средств и антисептиков, утвержденных приказом МОЗ Украины 14.12.2001 г. № 502. 1.3 Персонал должен быть ознакомлен со стандартной рабочей процедурой по подготовке рук. 1.4 Контроль микробиологической чистоты рук персонала проводят соответственно требованиям Методических рекомендаций по контролю микробиологической чистоты рук персонала, который работает в производственных помещениях, утвержденных приказом МОЗ Украины 14.12..2001г. № 502. 2. Обработка рук персонала 2.1 Обработку рук персонала следует проводить в такой последовательности: - открыть кран и смочить руки теплой водой. Рекомендуется использовать смесители, которые приводятся в действие без помощи пальцев рук (локтем, ногой, фотоэлементом); - налить мыльный раствор из специальной емкости-дозатора на ладони и тщательно вымыть руки до локтей. При необходимости для обработки околоногтевых пространств следует использовать стерильные щетки. Руки вытереть насухо полотенцем одноразового использования или высушить при помощи воздушной сушилки; - провести антисептическую обработку рук. Для этого на ладонь налить из дозатора около 5 мл антисептика, тщательно распределить его по внутренней и внешней поверхностям кисти, межпальцевым промежуткам и околоногтевым пространствам обеих рук и высушить. 2.2 После обработки рук персонал надевает комплект одежды. 2.3 После окончания работы руки рекомендуется смазывать смягчающими средствами. 21 3. Подготовка стерильных щеток 3.1 Подготовку щеток для мытья рук следует проводить в такой последовательности: - вымыть в растворе 0,5 % моющего средства; - прополоскать дважды в воде очищенной; - высушить в сушильном шкафу при температуре (55 ±5) ºС на протяжении 1,5-2 часов; - завернуть по одной в два слоя пергаментной бумаги и поместить в бикс; - провести стерилизацию в автоклаве при излишнем давлении 0,11 МПа (1,1 кгс/см2) и температуре (120± 1) ºС на протяжении 45 мин. 3.2 Сберегать стерильные щетки следует в биксах не более 5 суток, используя их по мере необходимости. Директор ГНЦЛС, Академик МИА В.П. Георгиевский УТВЕРЖДЕНО Приказ МОЗ Украины 14.12.2001 г. № 502 МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПОДГОТОВКЕ К РАБОТЕ И ПРАВИЛА ПОВЕДЕНИЯ ПЕРСОНАЛА 1. Общие положения 1.1 Эти методические рекомендации предлагают порядок подготовки и правила поведения персонала, который работает в производственных помещениях нестерильных лекарственных средств. 1.2 Методические рекомендации включают требования к состоянию здоровья и личной гигиены персонала, порядок подготовки его к работе в производственных помещениях и правила поведения при ведении технического процесса. 1.3 В своих действиях персонал должен руководствоваться соответствующими стандартными рабочими процедурами. 1.4 Правила, связанные с гигиеническими требованиями к персоналу, должны выполнять все лица, которые входят в производственные зоны. 1.5 В зонах производства, хранения и контроля качества лекарственных средств не должны находиться лица, которые не имеют специального разрешения. 2. Требования к состоянию здоровья и личной гигиене 2.1 При устройстве на работу персонал должен пройти медицинский осмотр согласно приказу Министерства здравоохранения Украины № 45 от 31.03.94 года «Об утверждении Положения о порядке проведения медицинских осмотров рабочих разных категорий.» Персонал, задействованный непосредственно в производстве, включая временных рабочих, должен регулярно проходить медицинские осмотры. 2.2 К работе, связанной с производством, хранением и контролем качества лекарственных средств, не должен допускаться персонал с инфекционными заболеваниями, открытыми ранами на коже и носители патогенной микрофлоры, пока их состояние здоровья не нормализуется. 2.3 Персонал должен ставить в известность своего руководителя о каких-либо симптомах заболевания, которые способны негативно повлиять на качество лекарственных средств. 2.4 Лица, которые курят, имеют специфическую кожу, хронический кашель, или у которых проявляется аллергия на материалы и предметы, используемые в данном производстве (одежду из текстильных материалов, химические вещества, моющие и дезинфекционные средства, изготавливаемая продукция и др.) нецелесообразно прилучать к работе в производстве нестерильных лекарственных средств в связи с возможными дополнительными загрязнениями указанными лицами рабочей зоны. 2.5 Персонал, который принимает участие в производстве, перед устройством на работу должен быть обучен правилам личной гигиены, и в дальнейшем проходить систематично санитарно-гигиеническое обучение и беспрекословно придерживаться гигиенических требований, которые отвечают его деятельности. 2.6 Персонал должен регулярно принимать душ, мыть голову не реже двух раз в неделю и особенно тщательно следить за чистотой рук. Запрещается иметь длинные ногти в связи с невозможностью надлежащей обработки околоногтевых просторов. Не допускается покрывать ногти лаком. 3. Порядок подготовки к работе в производственных помещениях 3.1 Порядок подготовки персонала к работе в помещениях производства нестерильных лекарственных средств должен исключать какую-либо возможность загрязнения одежды. Для этого необходимо правильно сделать планирование комнат для переодевания и определить способ правильного надевания одежды. 3.2 Планирование комнат для переодевания. 3.2.1 Планировочные решения комнат для переодевания могут быть разными в зависимости от класса чистоты производственных помещений, количества комнат, предназначенных для гардеробных, и от того, делятся ли комнаты на зоны поперечными лавками. Комнаты для переодевания могут иметь одно или двухкомнатную планировку. Планировка комнат должна предусматривать отдельные гардеробные, умывальные или душевые для персонала разного пола. 3.2.2 При однокомнатной планировке все процедуры переодевания выполняют в пределах одной комнаты. Поперечная лавка условно делит комнату на две зоны чистоты и служит для смены обуви при переходе с одной гардеробной в другую. 3.2.3 При двухкомнатной планировке для каждой гардеробной отведена отдельная комната. Поперечную лавку, которая служит для смены обуви, размещают в другой гардеробной. 3.3 Для хранения одежды могут использоваться шкафы, пакеты, ячейки или вешалки, которые размещают в однонаправленном потоке воздуха. Условия хранения одежды, если она используется снова при возвращении в чистое помещение, должны обеспечивать минимальное его загрязнение. 3.4 Основные процедуры подготовки персонала к работе. 3.4.1 В общественной гардеробной предприятия (цеха) персонал должен снять верхнюю одежду (пальто, плащ, куртку), головные уборы, обувь и надеть комплект переходной одежды (халат и тапочки), который используют для перемещения за пределами производственной зоны. 3.4.2 В первой гардеробной персонал должен снять переходную и повседневную одежду, чтобы чувствовать себя в производственном помещении комфортно. 3.4.3 Снять часы, кольца, ювелирные изделия. Такие предметы, как сигареты, зажигалки, ключи и другие подобные вещи должны храниться в безопасном месте. 3.4.4 Полностью удалить косметику. 3.4.5 Провести обработку рук соответственно требованиям Методических рекомендаций по обработке рук персонала, который работает в производственных помещениях, утвержденных приказом МОЗ Украины 14.12..2001г. № 502, не надевая перчаток. 3.4.6 Надевать специальный чехол на бороду, если это необходимо. 3.4.7 Перейти из первой гардеробной по специальному ковру, трижды переступив по нему, или через поперечную лавку в другую гардеробную. 3.4.8 Взять комплект одежды в месте его хранения, проверить целостность его упаковки, потом открыть упаковку. 3.4.9 Надеть защитную маску для лица и шапочку (или шлем). Маска может быть сверху на шапочке или под ней, способ мало влияет на степень защиты от загрязнений. Поэтому можно выбрать наиболее удобный способ. В любом случае, маска не должна размещаться ниже носа. Волосы должны быть полностью спрятаны под шапочкой. 3.4.10 Надеть халат или блузон и брюки таким образом, чтобы не загрязнить их внешнюю сторону. 3.4.11 Закрепить застежки или завязки. 3.4.12 Провести замену переходной обуви на обувь, предназначенную для производственных помещений. Эту операцию проводят без помощи рук. 3.4.13 Надеть защитные очки, (если это предусмотрено). 3.4.14 Проверить, используя зеркало в полный рост человека, все ли части одежды надеты правильно. 3.4.15 Обработать руки антисептиком и надеть стерильные перчатки. 3.4.16 Подготовленный таким образом персонал может входить в производственные помещения. 3.5 При выходе из производственного помещения необходимо провести операции переодевания в обратном порядке, сводя к минимуму загрязнения одежды (если одежда используется снова) или снять одежду одноразового использования и поместить ее в контейнер, специально для этого предназначенный. 4. Правила поведения при проведении технологического процесса 4.1. Персонал должен носить комплект специальной одежды, предусмотренный для данного производственного помещения. 4.2. В чистых помещениях не допускается пользоваться косметикой (пудрой, косметическими карандашами, аэрозолями и другими косметическими материалами). 4.3. Персонал должен правильно размещаться по отношению к продукту. Нельзя наклоняться над продуктом. При работе в однонаправленном потоке воздуха, нельзя допускать, чтобы люди размещались между продуктом и источником чистого воздуха. Метод работы следует спланировать заранее таким образом, чтобы свести к минимуму загрязнение. 4.4. Персонал должен избегать прямого контакта между руками оператора и выходящего сырья, материалами для первичной упаковки, промежуточной и нерасфасованной продукцией. Следует отдать предпочтение использованию вакуумных манипуляторов, длинных щипцов и др. 4.5. Персонал не должен прислонять материалы к себе при их перемещении в рабочей зоне. 4.6. Персонал не должен разговаривать, находясь над продуктом. При необходимости чихнуть или прокашляться следует отвернуться от продукта, потом заменить маску. 4.7. В производственных помещениях нельзя очищать нос. Это нужно делать в помещении для подготовки персонала, пользуясь безворсовыми одноразовыми материалами, которые после одноразового использования выбрасывают в контейнер, который закрывается. После этого проводят обработку рук. 4.8. Нельзя поднимать и пользоваться предметами, которые упали на пол во время работы, без их предварительной обработки. 4.9. В производственных помещениях не следует без необходимости касаться каких-либо поверхностей. 5. Правила поведения в производственных помещениях 5.1 С целью избежания загрязнения продукции в процессе производства необходимо придерживаться определенных правил поведения. Ниже приведены общие положения, которые следует адаптировать к конкретным производственным помещениям. 5.2 Правила поведения персонала непосредственно занятого в производстве лекарственных средств: 5.2.1 В производственное помещение должен входить персонал только после должной подготовки для работы в нем. 5.2.2 В производственные помещения допускаются лица, которые прошли специальную подготовку и инструктаж по правилам поведения на производстве. 5.2.3 В производственном помещении должен находиться исключительно только тот персонал, который занят в технологическом процессе. 5.2.4 В производственных помещениях запрещается употреблять пищу, курить, выращивать растения. Персонал не должен вносить и хранить в производственных помещениях предметы и материалы, которые могут стать причиной загрязнения. Некоторые из запрещенных предметов: - еда, напитки, жевательная резинка; - банки, бутылки; - предметы, связанные с курением; - радиоприемники, плееры, CD-проигрыватели и др. - абразивные материалы и порошки; - аэрозольные баллончики и бутылки; - личные лекарственные препараты; - вещи, сделанные из шерсти, резины, бумаги, хлопка, кожи и других природных материалов; - газеты, журналы, книги, бумажные носовые платки; - бумажники, кошельки, футляры для очков, ключи, документы, расчески и другие личные вещи; - карандаши, ластики и другие предметы для письма, жидкости для корректировки. 5.2.5 При входе и выходе двери нельзя оставлять открытыми, поскольку при этом может произойти перемена в разнице давления, или возникнуть нежелательное движение воздуха между помещениями. 5.2.6 Ненужно резко открывать и закрывать двери, поскольку это может привести к увеличению обмена воздухом между помещениями. 5.2.7 Проходя в помещение с более высоким классом чистоты через воздушный шлюз, персонал должен убедиться, что первые двери закрыты, и лишь потом открывать следующие двери. 5.2.8 Персонал должен входить в производственное помещение и покидать его только через зону переодевания. 5.2.9 В производственных помещениях персонал должен передвигаться равномерными шагами. Движения не должны быть резкими. 6. Правила поведения технического персонала 6.1 Монтаж и обслуживание оборудования должен обеспечивать технический персонал. 6.2 Технический персонал должен входить в производственное помещение только при необходимости. 6.3 Технический персонал должен знать и выполнять правила поведения в производственных помещениях или находиться под тщательным контролем во время пребывания в них. 6.4 Технический персонал должен быть одет в такую же одежду (или одежду, которая обеспечивает такую же эффективность), что и персонал производственного помещения, а также должен быть ознакомлен с методами переодевания при входе и выходе из помещений. 6.5 Инструмент, который используется для монтажных работ и сохраняется в производственном помещении, должен быть очищен, продезинфицирован или, при необходимости, простерилизован и использоваться исключительно в нем. 6.6 Инструмент, который необходимо внести в производственное помещение, должен быть заранее очищен, продезинфицирован а, при необходимости, простерилизован. Инструмент следует хранить и переносить в специально предназначенных пакетах или контейнерах; не позволяется использовать чемоданы или портфели. 6.7 Запасные части или другие предметы, которые имеют упаковку, должны быть освобождены от нее за зоной проведения работ, а сами детали очищены и обработаны дезинфицирующим раствором. 6.8 Технический персонал не должен вносить в производственное помещение предметы и материалы, указанные выше в п. 5.2.4. 6.9 По окончании работ технический персонал должен провести уборку зоны работы, используя специальное оборудование и средства для очистки, которые разрешены к использованию в этом помещении. Директор ГНЦЛС, Академик МИА В.П. Георгиевский 28 УТВЕРЖДЕНО Приказ МОЗ Украины 14.12. 2001 г. № 502 МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПОДГОТОВКЕ МАТЕРИАЛОВ ДЛЯ ПЕРВИЧНОЙ УПАКОВКИ 1. Общие положения 1.1 Эти методические рекомендации предлагают порядок подготовки материалов для первичной упаковки нестерильных лекарственных средств. 1.2 Подготовка материалов для первичной упаковки включает порядок их освобождения от тары, пересмотра и отбраковки (при необходимости), мытье, сушение и термическая обработка. 1.3 Персонал, который осуществляет подготовку материалов для первичной упаковки, должен быть ознакомлен со стандартными рабочими процедурами, по подготовке материалов для первичной упаковки. 1.4 Контроль микробиологической чистоты материалов для первичной упаковки проводят соответственно требованиям Методических рекомендаций по контролю микробиологической чистоты материалов для первичной упаковки, утвержденных приказом МОЗ Украины 14.12. 2001 г. № 502. 2. Подготовка материалов для первичной упаковки 2.1 Подготовку материалов для первичной упаковки, которые требуют специальной обработки, рекомендуется проводить на современном полифункциональном оборудовании с программным управлением, которое представляет собой единый комплекс аппаратов для проведения всех операций. 2.2 Освобождение от тары рекомендуется проводить с использованием полуавтомата, который обеспечивает поднятие ее на уровень транспортирующего устройства, послойное сдвигание и накопление на стол и подача на просмотр. 2.3 Пересмотр и отбраковку материалов для первичной упаковки проводят до начала стадии мытья. 2.4 Пересмотр может осуществляться визуально, например, на осмотрочных столах, оборудованных устройством для переворачивания и лампами дневного света. Отбраковке подлежат материалы для первичной упаковки, которые имеют отклонения на внешний вид от требований действующей нормативной документации. 2.5 Подготовку материалов для первичной упаковки проводят автоматическим или ручным способом. 2.6 Автоматическая подготовка материалов для первичной упаковки (флаконов, банок и др.). 2.6.1 Материалов для первичной упаковки поступают к машине автоматической мойки после их пересмотра и отбраковки. 2.6.2 Автоматическое мытье проводят согласно инструкции по эксплуатации моющего оборудования. При этом следует придерживаться следующих требований: - загрязненные материалы для первичной упаковки обмывают водопроводной водой, которую потом сливают. После этого проводят их замачивание на 25±5 мин. в горячем (65±5) ºС 0,5% растворе моющего средства и моют в этом же растворе; - ополаскивают снаружи и изнутри беспрерывной струей горячей (65±5) ºС воды очищенной на протяжении 30-35 сек. 2.6.3 После споласкивания материалы для первичной упаковки продувают очищенным сжатым воздухом и подают в сушильно-стерилизационный тоннель, который имеет зону подогрева (температура не меньше 170 ºС) и зону охлаждения (температура (45±5) ºС). Охлаждение проводят очищенным воздухом. 2.6.4 Качество подготовки материалов для первичной упаковки проверяют выборочно визуально на отсутствие механического загрязнения и влаги. В случае выявления в одной кассете двух или более (с десяти пересмотренных) единиц с механическими загрязнениями, всю партию материалов для первичной упаковки подают на повторное мытье; при наличии влаги – на повторное сушение. 2.7 Ручное мытье материалов для первичной упаковки. 2.7.1 Ручное мытье проводят с использованием 3-х секционной моечной установки. 2.7.2 Первую секцию моечной установки наполняют на 3/4 объема водопроводной водой, которая имеет температуру (45±5) ºС, потом загружают материалы для первичной упаковки так, чтобы уровень «водного зеркала» над ним был 5-7 см. В том случае, если материалы для первичной упаковки загрязнены, их моют в 0,5% растворе моющего средства. 2.7.3 Материалы для первичной упаковки моют путем перемешивания на протяжении 3-5 мин. в зависимости от степени их загрязнения. В случае сильного загрязнения их моют при помощи устройства, предназначенного для мытья стеклянной посуды. 2.7.4 Вымытые таким образом материалы для первичной упаковки перекладывают в другую секцию моечной установки, ополаскивают водопроводной водой путем перемешивания, заливают воду и снова повторяют споласкивание чистой водой. 2.7.5 Материалы для первичной упаковки перекладывают в третью секцию моечной установки и ополаскивают водой очищенной не меньше трех раз. 2.7.6 Чистоту вымытых материалов для первичной упаковки проверяют выборочно визуально на отсутствие посторонних примесей и равномерность стока воды со стенок после споласкивания. 2.7.7 Чистые материалы для первичной упаковки после последнего споласкивания устанавливают в кассеты дном вверх. 2.8 Подготовка закупорочных материалов для первичной упаковки (пробок, крышек и др.). 2.8.1 Первичные закупорочные материалы (далее материалы) помещают в стиральную машину, заполненную горячим (температура (65±5) ºС) 0,5% раствором моющего средства и моют на протяжении 2-3 мин. Объем моющего раствора должен превышать насыпной объем материалов в 1,5-2 раза. Потом моющий раствор сливают в канализацию. 2.8.2 В стиральную машину заливают водопроводную воду и проводят споласкивание материалов не менее трех раз. 2.8.3 Водопроводную воду сливают, потом заливают горячую водопроводную воду (температура (65±5) ºС) и выдерживают 20 мин. Воду сливают в канализацию. 2.8.4 После этого материалы споласкивают водой очищенной не менее двух раз. В промывочных водах после последнего споласкивания должны отсутствовать механические примеси, которые можно видеть невооруженным глазом. 2.8.5 Вымытые материалы сушат в сушильном шкафу при температуре (55±5) ºС на протяжении 3 часов, за исключением материалов, для которых, соответственно требованиям их нормативной документации, отмеченные режимы термической обработки не могут быть использованы. 2.9 Допускается использование других режимов термической обработки материалов для первичной упаковки и первичных закупорочных материалов, которые обеспечивают соответственное качество подготовки и сохранения объекта при условии их обоснования и валидации метода. Режим должен быть указан в нормативной документации. 2.10 Подготовка ваты, которая используется для заполнения свободного пространства в первичной упаковке. 2.10.1 Вату (не более 100 г) следует завернуть в два слоя растительного пергамента или поместить в мешочки из безворсовой ткани и снова завернуть в один слой растительного пергамента. Свертки поместить, не уплотняя, в биксы или другие контейнеры, которые закрываются крышками, и передать на термическую обработку в паровой стерилизатор. 2.10.2 Термическую обработку следует проводить в паровом стерилизаторе при избыточном давлении 0,11 Мпа (1,1 кгс/см2) и температуре (120±1) ºС на протяжении 45 мин. После окончания процесса термической обработки необходимо спустить пар, подсушить вату и в контейнерах передать на участок фасования. 2.11 Контроль параметров и эффективность термических методов обработки осуществляется с помощью контрольно-измерительных приборов и химических индикаторов. Химические индикаторы следует подбирать с учетом температуры, которая используется для термообработки материалов. 2.13 Регистрируют показания контрольно-измерительных приборов и результаты контроля, который осуществляется с помощью химических индикаторов. 2.14 Подготовленные материалы для первичной упаковки и закупорочные материалы должны быть использованы сразу же для упаковки лекарственных средств. Срок их хранения не может превышать больше 48 часов при условиях, которые максимально защищают от повторного загрязнения. 2.14 Стерилизованный материал для первичной упаковки и закупорочные материалы, которые поступают от производителя в герметичной упаковке, следует освобождать от упаковки и пересматривать в условиях, которые максимально снижают риск контаминации микроорганизмами и механическими частицами. Директор ГНЦЛС, Академик МИА В.П. Георгиевский УТВЕРЖДЕНО Приказ МОЗ Украины 14.12. 2001 г. № 502 МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОНТРОЛЮ СОДЕРЖАНИЯ МИКРООРГАНИЗМОВ И ЧАСТИЧЕК В ВОЗДУХЕ ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЙ 1. Общие положения 1.1 Эти методические рекомендации предлагают порядок проведения контроля содержания микроорганизмов и частичек в воздухе помещений производства нестерильных лекарственных средств. 1.2 Под содержанием микроорганизмов в воздухе следует понимать количество жизнеспособных микроорганизмов, которые находятся в 1 м 3 воздуха производственных помещений. 1.3 Под количеством частичек в воздухе следует понимать количество частичек полидисперсного состава, которые находятся в 1 м 3 воздуха производственных помещений. 1.4 Контроль содержания микроорганизмов в воздухе производственных помещений следует проводить во время производственного процесса: помещений класса С не реже двух раз в неделю, помещений класса D не реже одного раза в неделю. 1.5 Контроль содержания частичек в воздухе производственных помещений следует проводить до начала производственного процесса (помещения в «оснащенном» состоянии): помещений класса С не реже одного раза в месяц, помещений класса D не реже одного раза в три месяца. 1.6 В производственных помещениях, в которых осуществляют измельчение и расфасовку лекарственного растительного сырья, которое подлежит термической обработке, контроль содержания микроорганизмов и частичек в воздухе во время производственного процесса не проводят. 1.7 Проверку ростовых свойств питательных сред проводят согласно с рекомендациями ГФУ (разделы 2.6.12.; 2.6.13.). 1.8 Персонал, который осуществляет контроль, должен работать в комплекте одежды, предусмотренном для помещений данного класса чистоты. Персонал должен быть ознакомлен со стандартными рабочими процедурами по контролю содержания микроорганизмов и частичек в воздухе производственных помещений и правилами техники безопасности при работе с приборами. 2. Правила отбора проб 2.1 Для каждого помещения составляют план отбора проб воздуха. 2.2 План отбора проб должен включать: - указание точек отбора проб (контрольных точек); - указание частоты (периодичности) контроля для каждой точки; - указание количества проб в каждой точке; - указание времени (моментов времени) рабочего дня (смены), когда проводится отбор проб; - указание характера технологического процесса в момент отбора проб; - указание критических точек контроля. 2.1 Отбор проб должен быть организован таким образом, чтобы влияние его на производственный процесс было минимальным. 2.2 Количество и местонахождение контрольных точек устанавливают в зависимости от площади производственного помещения и характера технологических операций, которые в нем выполняются. 2.3 Контроль содержания микроорганизмов в воздухе проводят преимущественно в тех рабочих зонах, где находятся наиболее вероятные источники микробной контаминации воздуха (места с большим количеством персонала, места с повышенным риском образования пыли и т.д.), а также в тех рабочих зонах, где субстанции, вспомогательные вещества, готовый продукт и т.п. непосредственно контактируют с окружающей средой. 2.4 При определении содержания частичек в воздухе минимальное количество точек отбора проб воздуха (N) определяют с округленного в сторону большего числа значения:
где: S – площадь помещения (м2), в котором проводится отбор проб воздуха Количество точек отбора проб должно быть не меньше двух. 2.7 При определении содержания частичек в помещениях с вертикальным однонаправленным и неоднонаправленным потоком воздуха, точки отбора проб должны быть равномерно распределены по площади, параллельной площади пола, или по вертикали, если это необходимо. В помещениях с невертикальным однонаправленным воздушным потоком площадь точек отбора проб должна быть перпендикулярной направлению воздушного потока. 2.8 Если при определении содержания частичек в воздухе некоторые точки отбора проб попадают на места, занятые оборудованием, то их смещают в места, наиболее критичные к требованиям защиты продукции (технологического процесса) от аэрозольных частичек. 3. Контроль содержания микроорганизмов 3.1 Оборудование и методы контроля. 3.1.1 Контроль содержания микроорганизмов в воздухе производственных помещений проводят аспирационным методом, который основан на принципе ударного действия потока воздуха. 3.1.2 Для контроля содержания микроорганизмов в воздухе используют пробоотборники инерционного типа (импакторы). 3.1.3 Допускается использование пробоотборников другого типа, которые имеют устройства для замера объемов воздуха, который протягивается и времени отбора, при условии валидации методики и обоснование предельно допустимого количества микроорганизмов. 3.1.4 Техническое обслуживание приборов проводится представителем службы, который проводит контроль измерительных приборов согласно с инструкцией по их эксплуатации. 3.2 Подготовка к проведению испытаний. 3.2.1 Проводят проверку ростовых свойств питательных сред согласно с рекомендациями ГФУ (раздел 2.6.12). 3.2.2 В день испытания готовят чашки Петри с питательной средой. Для этого в каждую чашку Петри вносят от 15 до 25 мл расплавленную и охлажденную до (45±5) ºС питательную среду, придерживаясь правил асептики, закрывают чашки крышками и дают среде застыть. 3.2.3 Для проявления роста бактерий используют питательную среду № 1, для проявления роста грибов – питательную среду № 2 для контроля микробиологической чистоты лекарственных средств, которые описаны в Государственной Фармакотерапии Украины (ГФУ), раздел 2.6.13. Допускается использование других питательных сред, равноценных по чувствительности и ростовым свойствам. 3.2.4 Подготовленные чашки Петри помещают в бикс и используют при дальнейшем отборе проб. 3.2.5 Перед передачей прибора-пробоотборника, биксов с чашками Петри и другими материалами в производственные помещения их внешние поверхности необходимо обработать спиртом этиловым (объемная масса 76%). 3.2.6 Передачу приборов и материалов в помещения с более высоким классом чистоты следует осуществлять через переходные помещения или воздушные шлюзы. 3.3 Проведение испытаний. 3.3.1 Контроль содержания микроорганизмов в воздухе следует осуществлять в строгом соответствии с планом отбора проб воздуха производственных помещений. 3.3.2 Испытание аспирационным методом. 3.3.2.1 При отборе проб в помещениях с ламинарным потоком воздуха и, особенно, при отборе проб полидисперсного аэрозоля, следует придерживаться изокинетичности отбора – равности скоростей воздуха в пробоотборнике и в потоке, который исследуется. 3.3.2.2 В каждой контрольной точке отбирают пробы в две или более чашки Петри с питательной средой для выращивания бактерий и питательной средой для выращивания грибов. 35 3.3.2.3 Объем пробы зависит от ожидаемой концентрации микроорганизмов в воздухе. Суммарный объем пробы должен быть таким, чтобы для каждой контрольной точки суммарное число колоний, которые выросли на поверхности агара во всех чашках Петри, было не меньше 40. 3.3.2.4 Минимальный суммарный объем пробы V (м3) в каждой контрольной точке вычисляют по формуле:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Количество точек, n |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
| t фактор |
6,3 |
2,9 |
2,3 |
2,1 |
2,0 |
1,9 |
1,9 |
1,8 |
Директор ГНЦЛС,
Академик МИА В.П. Георгиевский
УТВЕРЖДЕНО
Приказ МОЗ Украины
14.12. 2001 г. № 502
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИИ
ПО КОНТРОЛЮ МИКРОБИОЛОГИЧЕСКОЙ ЧИСТОТЫ
ПОВЕРХНОСТЕЙ ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЙ
1. Общие положения
1.1 Эти методические рекомендации предлагают порядок проведения контроля микробиологической чистоты поверхностей производственных помещений в производстве нестерильных лекарственных средств, а именно определение общего количества бактерий и грибов в смывах взятых с площади 100 см2.
1.2 Задание контроля – проверка эффективности обработки дезинфекционными растворами поверхностей производственных помещений (стен, полов, дверей), рабочих столов и т.д. и определение их микробиологической чистоты во время производственного процесса.
1.3 В случае контаминации лекарственного средства бактериями семейства Enterobacteriaceae, Staphylococcus aureus и Pseudomonas aeruginosa проводят контроль микробной контаминации поверхностей производственных помещений этими микроорганизмами.
1.4 Контроль микробиологической чистоты поверхностей производственных помещений проводят не реже одного раза в неделю во время производственного процесса и не реже одного раза в месяц после обработки дезинфекционными растворами.
1.5 Для контроля микробиологической чистоты производственных помещений используют метод смывов тампонами или метод отпечатков. Допускается использование других методов при условии их валидации и обоснования предельно допустимого количества микроорганизмов.
1.6 Проверку пригодности методики и ростовых способностей питательных сред проводят согласно с рекомендациями ГФУ (разделы 2.6.12; 2.6.13).
1.7 Посуда, питательные среды и растворы, которые используются для контроля, должны быть стерильными.
1.8 Персонал, который осуществляет контроль, должен работать в комплекте специальной одежды, предусмотренной для помещений такого класса чистоты, где проводится контроль. Персонал должен быть ознакомлен со стандартной рабочей процедурой по контролю микробиологической чистоты поверхностей производственных помещений.
1.9 В производственных помещениях, где осуществляют измельчение и расфасовку лекарственного растительного сырья, которое подлежит термической обработке, контроль микробиологической чистоты поверхностей во время производственного процесса не обязательный.
2. Подготовка к проведению испытаний
2.1 Испытания методом смывов.
2.1.1 Перед началом испытания готовят стерильные ватные тампоны на стеклянных или металлических держателях, пипетки на 1или 2 мл, чашки Петри, пробирки с 10 мл стерильного буферного раствора с натрия хлоридом и пептоном pH 7.0, описанного в ГФУ (раздел 2.6.13) и стерильные трафареты размером 10´10 см. Тампоны могут быть вмонтированы в ватно-марлевые пробки пробирок, которые содержат по 2 мл стерильного буферного раствора с натрия хлоридом и пептоном pH 7.0.
2.1.2 В буферный раствор с натрия хлоридом и пептоном pH 7.0, при необходимости, добавляют соответствующий инактиватор, который дает возможность эффективно нейтрализовать средства, которые использовались для дезобработки. Необходимое количество инактиватора определяют при проверке пригодности методики.
2.1.3 Тампоны и, при необходимости, пробирки с 10 мл стерильного буферного раствора с натрия хлоридом и пептоном pH 7.0 помещают в бикс.
2.2 Испытания методом отпечатков.
2.2.1 Готовят агаровые пластины одним из приведенных ниже способов:
- в чашки Петри диаметром 100 мм по радиусам закладывают 4 куска марли, стерилизуют, потом заливают питательной средой. После застывания среды ее разрезают на 4 сектора, придерживаясь правил асептики;
- заливают питательную среду в углубление крышечки бакпечати и дают застыть;
- готовят контактные чашки соответственно МВГ 07.003.98, п. 8.4.1, с. 26.
2.2.2 Используют готовые агаровые пластины.
2.2.3 Подготовленные материалы помещают в бикс.
2.3 Перед передачей биксов с материалами в производственные помещения их внешние поверхности обрабатывают спиртом этиловым (объемная часть 76%).
2.4 Передачу материалов в помещения с более высоким классом чистоты следует осуществлять через переходные помещения или воздушные шлюзы.
2.5 Для выявления роста бактерий используют питательную среду № 1, для выявления роста грибов – питательную среду № 2 для контроля микробиологической чистоты лекарственных средств, которые описаны в ДФУ (раздел 2.6.13). Допускается использование других питательных сред, равнозначных по чувствительности и ростовым свойствам.
3. Правила отбора проб
3.1 Для каждого помещения составляют план отбора проб, который должен включать:
- указание точек отбора проб (контрольных точек);
- указание частоты (периодичности) контроля для каждой точки;
- указание количества проб в каждой точке;
- указание времени (моментов времени) рабочего дня (смены), когда проводится отбор проб;
- указание критических точек контроля.
3.2 Отбор проб должен быть организован таким образом, чтобы его влияние на производственный процесс было минимальным.
3.3 Количество и местонахождение контрольных точек устанавливают в зависимости от площади производственного помещения и характера операций, которые выполняются в нем.
3.4 Контроль микробиологической чистоты поверхностей производственных помещений рабочей зоны проводят преимущественно в тех местах, где находятся более вероятные источники микробной контаминации.
3.5 Для получения достоверных результатов на одной поверхности отбирают пробы в нескольких контрольных точках, размещенных в произвольном порядке.
3.6 Отбор проб методом смывов.
3.6.1 На месте взятия смыва тампон увлажняют фосфатным буферным раствором, который находится в пробирке, и тщательно протирают увлажненным тампоном участок площадью 100 см2, используя трафарет. Один трафарет используют для взятия одного смыва. Допускается взятие смывов с площади 25 см2 на четырех участках.
3.7 Отбор проб методом отпечатков.
3.7.1 Метод применяют преимущественно для контроля микробиологической чистоты гладких и ровных поверхностей.
3.7.2 Агаровые пластины прикладывают к поверхности, которая исследуется.
3.7.3 В одной контрольной точке делают отпечаток на две пластины с питательной средой для выращивания бактерий на две пластины с питательной средой для выращивания бактерий и на две пластины для выращивания грибов.
3.7.4 При проведении испытания на наличие бактерий семейства Enterobacteriaceae, Staphylococcus aureus и Pseudomonas aeruginosa дополнительно делают отпечатки на пластины с соответствующей питательной средой.
3.7.5 Пластины изолируют от внешней среды (отпечатки, полученные на секторах агара, помещают назад в чашки Петри, закрывают крышкой бакпечать и т.д.).
- Проведение испытаний
4.1 Испытания проводят в лаборатории, придерживаясь правил асептики.
4.2 Испытания методом смывов.
4.2.1 Каждый тампон тщательно ополаскивают в пробирке, которая содержит 10 мл буферного раствора с натрия хлоридом и пептоном pH 7.0.
С каждой пробирки, которая вмещает смывную жидкость, делают посев по 1 мл в две чашки Петри с питательной средой для выращивания бактерий и в две с питательной средой для выращивания
4.2.2. грибов, используя один из приведенных ниже методов, описанных в ГФУ (раздел 2.6.12) для испытания микробиологической чистоты нестерильных лекарственных средств:
- методом глубинного посева;
- методом двухслойного посева.
4.2.3 Чашки Петри с питательной средой для выращивания бактерий инкубируют при температуре 32,5±2,5 ºС, с питательной средой для выращивания грибов при температуре 22,5±2,5 ºС не менее 5 суток.
4.2.4 При проведении испытания на наличие бактерий семейства Enterobacteriaceae, S.aureus и P. aeruginosa 5 мл смывной жидкости вносят в 50 мл соответственных питательных средств и инкубируют при температуре 32,5±2,5 ºС на протяжении 48 часов.
4.3 Испытания методом отпечатков.
4.3.1 Агаровые пластины с питательной средой для выращивания бактерий инкубируют при температуре 32,5±2,5 ºС, с питательной средой для выращивания грибов при температуре 22,5±2,5 ºС не менее 5 суток.
4.4 Проводят контроль стерильности питательных сред. Для этого от каждой партии питательных сред отбирают 2 чашки Петри , 2 агаровые пластины или 2 емкости с жидкой питательной средой и инкубируют при соответствующей температуре на протяжении 48 часов. После окончания периода инкубации на питательных средах не должен наблюдаться рост микроорганизмов. Контроль стерильности питательных сред проводят до начала испытания или одновременно с ним
4.5 В случае наличия роста микроорганизмов на контрольных питательных средах, партию питательной среды считают непригодной, а испытание, проведенное с использованием этой партии среды – недействительным. Испытание повторяют на пригодной партии питательной среды.
5. Учет результатов
5.1 После окончания инкубации проводят подсчет количества колоний микроорганизмов, которые образовались в каждой чашке или на пластине.
5.2 При испытании методом смывов для каждой контрольной точки подсчитывают количество колоний во всех чашках Петри с каждой питательной средой, находят среднее арифметическое значение и, умножая его на 10, вычисляют количество бактерий и грибов в смывах со 100 см2 площади поверхности.
5.3 При испытании методом отпечатков для каждой контрольной точки подсчитывают число колоний на всех агаровых пластинах с каждой питательной средой, находят среднее арифметическое значение и вычисляют число бактерий и грибов на 100 см2 площади поверхности по формуле:
![]() ,
,
где:
X – число колонеобразующих микроорганизмов на площади 100 см2;
N – среднее арифметическое значение числа колоний микроорганизмов;
S – площадь пластины (см2).
5.4 При проведении испытания на наличие бактерий семейства Enterobacteriaceae, S.aureus и P. aeruginosa идентификацию микроорганизмов проводят используя методы, которые описаны в ГФУ (раздел 2.6.13) или другой специальной литературе.
5.5 На поверхностях производственных помещений непосредственно после обработки дезинфицирующими растворами не должны находиться жизнеспособные микроорганизмы.
5.6 Предельно допустимое количество микроорганизмов (бактерий и грибов суммарно) в смывах или отпечатках с площади поверхности производственных помещений 100 см2 во время производственного процесса устанавливает производитель для каждой технологической операции в зависимости от требований к микробиологической чистоте готовых лекарственных средств. Предельно допустимое количество микроорганизмов должно быть обосновано при валидации производства.
5.7 На поверхностях производственных помещений в процессе производства не допускается наличие бактерий семейства Enterobacteriaceae, S.aureus и P. aeruginosa.
5.8 Результаты испытаний регистрируют.
Директор ГНЦЛС,
Академик МИА В.П. Георгиевский
УТВЕРЖДЕНО
Приказ МОЗ Украины
14.12. 2001 г. № 502
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИИ
ПО КОНТРОЛЮ МИКРОБИОЛОГИЧЕСКОЙ ЧИСТОТЫ
ТЕХНОЛОГИЧЕСКОГО ОБОРУДОВАНИЯ И ИНВЕНТАРЯ
- Общие положения
1.1 Эти методические рекомендации предлагают порядок проведения контроля микробиологической чистоты технологического оборудования и инвентаря, который используется в производстве нестерильных лекарственных средств, а именно определение общего количества бактерий и грибов в смывах взятых с поверхности площадью 100 см2.
1.2 Заданием контроля есть проверка эффективности обработки оборудования и инвентаря дезинфекционными растворами.
1.3 В случае контаминации лекарственного средства бактериями семейства Enterobacteriaceae, Staphylococcus aureus и Pseudomonas aeruginosa поводят контроль микробиологической чистоты технологического оборудования и инвентаря этими микроорганизмами.
1.4 Контроль микробиологической чистоты технологического оборудования и инвентаря поводят не реже одного раза в месяц после обработки дезинфицирующими средствами и соответствующей экспозиции.
1.5 Для контроля микробиологической чистоты технологического оборудования и инвентаря используют метод смывов тампонами. Допускается использование других методов при условии их валидации и обоснования максимально допустимого количества микроорганизмов.
1.6 Проверку ростовых свойств питательных сред проводят согласно с рекомендациями ГФУ (разделы 2.6.12; 2.6.13).
1.7 Посуда, питательные среды и растворы, которые используются для контроля, должны быть стерильными.
1.8 Персонал, который осуществляет контроль, должен работать в комплекте специальной одежды, предусмотренной для помещений того класса чистоты, где размещены оборудование и инвентарь, которые контролируются. Персонал должен быть ознакомлен со стандартной рабочей процедурой по микробиологическому контролю технологического оборудования и инвентаря.
- Подготовка к проведению испытаний
2.1 Перед началом испытания готовят стерильные ватные тампоны на стеклянных или металлических держателях, пипетки на 1, 2,5 и 10 мл, чашки Петри, пробирки с 10 мл стерильного буферного раствора с натрия хлоридом и пептоном pH 7.0, описанного в ГФУ (раздел 2.6.13) и стерильные трафареты размером 10´10 см. Тампоны могут быть вмонтированы в ватно-марлевые пробки пробирок, которые содержат по 2 мл стерильного буферного раствора.
2.2 Тампоны и, при необходимости, пробирки с 10 мл стерильного буферного раствора с натрия хлоридом и пептоном pH 7.0 помещают в бикс.
2.3 Перед подачей биксов с материалами в производственное помещение их внешние поверхности обрабатывают спиртом этиловым (объемная часть 76%).
2.4 Передачу материалов в помещения с более высоким классом чистоты следует осуществлять через переходные помещения или воздушные шлюзы.
2.5 Для выявления роста бактерий используют питательную среду № 1, для выявления роста грибов – питательную среду № 2 для контроля микробиологической чистоты лекарственных средств, которые описаны в ДФУ (раздел 2.6.13). Допускается использование других питательных сред, равнозначных по чувствительности и ростовым свойствам.
2.6 Для выявления и идентификации бактерий семейства Enterobacteriaceae, Staphylococcus aureus и Pseudomonas aeruginosa используют питательные среды и реактивы, которые описаны в ГФУ (раздел 2.6.13), или другие питательные среды, равнозначные по чувствительности и ростовым свойствам.
3. Правила отбора проб
3.1 Для каждого помещения составляют план отбора проб:
- указание точек отбора проб (контрольных точек);
- указание частоты (периодичности) контроля для каждой точки;
- указание количества проб в каждой точке;
- указание времени (моментов времени) рабочего дня (смены), когда проводится отбор проб;
- указание критических точек контроля.
3.2 Количество и местонахождение контрольных точек устанавливают в зависимости от размеров технологического оборудования, инвентаря и характера технологических операций, которые выполняются на нем.
3.3 Проводят контроль тех поверхностей оборудования и инвентаря, которые во время производственного процесса контактируют с субстанциями, вспомогательными веществами, готовым продуктом и первичной упаковкой.
3.4 Для получения достоверных результатов отбирают пробы на одной поверхности в нескольких контрольных точках, размещенных в произвольном порядке.
3.5 На месте взятия проб смыва тампон увлажняют буферным раствором, который находится в пробирке, и тщательно протирают увлажненным тампоном участок площадью 100 см2, используя трафарет. Один трафарет используют для взятия одного смыва.
3.6 В том случае когда нет возможности взять смывы с площади 100 см2, допускается взятие смывов с меньшей площади (не менее 25 см2). Смывы с мелких предметов берут со всей поверхности.
4. Проведение испытаний
4.1 Испытания проводят в лаборатории, придерживаясь правил асептики.
4.2 Каждый тампон тщательно ополаскивают в пробирке, которая содержит 10 мл буферного раствора с натрия хлоридом и пептоном pH 7.0.
4.3 С каждой пробирки, которая вмещает смывную жидкость, делают посев по 1 мл в две чашки Петри с питательной средой для выращивания бактерий и в две - с питательной средой для выращивания грибов, используя один из приведенных ниже методов, описанных в ГФУ (раздел 2.6.12) для испытания микробиологической чистоты нестерильных лекарственных средств:
- методом глубинного посева;
- методом двухслойного посева.
4.4 Чашки Петри с питательной средой для выращивания бактерий инкубируют при температуре 32,5±2,5 ºС, с питательной средой для выращивания грибов при температуре 22,5±2,5 ºС не менее 5 суток.
4.5 При проведении испытания на наличие бактерий семейства Enterobacteriaceae, S.aureus и P. aeruginosa 5 мл смывной жидкости вносят в 50 мл соответственных питательных средств и инкубируют при температуре 32,5±2,5 ºС на протяжении 48 часов.
4.6 Проводят контроль стерильности питательных сред. Для этого по 2 чашки Петри и по две емкости с жидкой питательной средой от каждой партии питательных сред помещают в термостат, и инкубируют при соответствующей температуре на протяжении 48 часов. После окончания периода инкубации на питательных средах не должен наблюдаться рост микроорганизмов. Контроль стерильности питательных сред проводят до начала испытания или одновременно с ним
4.7 В случае наличия роста микроорганизмов на контрольных питательных средах, партию питательной среды считают непригодной, а испытание, проведенное с использованием этой партии среды – недействительным. Испытание повторяют на пригодной партии питательной среды.
5. Учет результатов
5.1 После окончания срока инкубации проводят пересмотр чашек на наличие роста микроорганизмов.
5.2 При проведении испытания на наличие бактерий семейства Enterobacteriaceae, S.aureus и P. aeruginosa идентификацию микроорганизмов проводят используя методы, которые описаны в ГФУ (раздел 2.6.13) или другой специальной литературе.
5.3 В смывах с технологического оборудования и инвентаря непосредственно после их обработки не должны находиться жизнеспособные микроорганизмы.
5.4 Результаты испытаний регистрируют.
Директор ГНЦЛС,
Академик МИА В.П. Георгиевский
УТВЕРЖДЕНО
Приказ МОЗ Украины
14.12. 2001 г. № 502
МЕТОДОЛОГИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО КОНТРОЛЮ МИКРОБИОЛОГИЧЕСКОЙ ЧИСТОТЫ
ОДЕЖДЫ ПЕРСОНАЛА, КОТОРЫЙ РАБОТАЕТ
В ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЯХ
- Общие положения.
1.1. Эти методологические рекомендации предлагают порядок проведения контроля микробиологической чистоты одежды персонала, который работает в производственных помещениях нестерильных лекарственных препаратов, а именно определение количества жизнеспособных бактерий и грибов и наличие бактерий семейства Enterobacteriaсeae в смывах, взятых с поверхности одежды площадью 100 см2.
1.2. Задачей контроля является проверка эффективности термической обработки одежды и перчаток, и определение микробиологической чистоты одежды во время производственного процесса.
1.3. В случае контаминации лекарственного препарата бактериями S. aureus и P. aeruginosa проводят контроль микробиологической чистоты одежды этими микроорганизмами.
1.4. Контроль эффективности термической обработки одежды и перчаток проводят выборочно не реже одного раза на месяц непосредственно перед использованием (во время раскрытия упаковок).
1.5. Контроль микробиологической чистоты одежды во время производственного процесса проводят выборочно у некоторых работников не реже одного раза в неделю.
1.6. Контроль перчаток во время производственного процесса осуществляют в соответствии с требованиями Методологических рекомендации по контролю микробиологической чистоты одежды персонала, который работает в производственных помещениях, утвержденный приказом МОЗ Украины 14.12.2001 г. № 502.
1.7. Для контроля эффективности термической обработки одежды и перчаток и микробиологической чистоты одежды во время производственного процесса используют метод смыва тампонами. Допускается применение других методов при условии их валидации и обоснования максимально допустимого количества микроорганизмов.
1.8. Проверка возможностей роста питательной среды производиться в соответствии с рекомендациями ДФУ (разделы 2.6.1; 2.6.12; 2.6.13).
1.9. Посуда, питательная среда и растворы, которые используются для контроля, должны быть стерильными.
1.10. Персонал, который осуществляет контроль, должен работать в комплекте одежды, предусмотренной для помещений того класса чистоты, где производиться контроль. Персонал должен быть ознакомлен со стандартной рабочей процедурой по микробиологическому контролю одежды и перчаток.
1.11. В производственных помещениях, где осуществляется измельчение и расфасовка лекарственного растительного сырья, которое подлежит термической обработке, контроль микробиологической чистоты одежды во время производственного процесса не обязателен.
2. Подготовка к проведению испытания.
2.1. Перед началом испытания приготавливают стерильные ватные тампоны на стеклянных или металлических держателях, пипетки на 1, 2, 5 и 10 мл, чашки Петри, пинцеты, ножницы, пробирки с 10 мл буферного раствора с натрием хлоридом и пептоном рН 7.0, описанного в ДФУ(2.6.13), и стерильные трафареты размером 100 см2 и 25 см2. Тампоны могут быть встроены в ватно-марлевые пробки пробирок, которые содержат по 2 мл буферного раствора с натрием хлоридом и пептоном рН 7.0.
2.2. Тампоны и, по надобности, пробирки с 10 мл буферного раствора с натрием хлоридом и пептоном рН 7.0 помещают в бокс.
2.3. Перед передачей боксов с материалами в производственные помещения их внешние поверхности обрабатывают 76 % этиловым спиртом.
2.4. Передачу материалов в помещения с более высоким классом чистоты следует осуществлять через проходные помещения или воздушные шлюзы.
2.5. Для определения роста бактерий используют питательную среду № 1, для определения роста грибов – среду № 2, для определения бактерий семейства Enterobacteriaceae – среду № 3, которые описаны в ДФУ (раздел 2.6.13). Допускается применение других питательных сред, одинаковых по чувствительности и способностям роста.
2.6. Для определения и идентификации S. aureus и P. aeruginosa используются питательные среды и реактивы, которые описаны в ДФУ (раздел 2.6.13), или другие питаельные среды, одинаковые по чувствительности и способностям роста.
3. Правила отбора проб.
3.1. Для каждого помещения составляют план отбора проб, который должен включать:
- указание точек отбора проб (контрольных точек);
- указание частоты (периодичности) контроля для каждой точки;
- указание количества проб в каждой точке;
- указание времени (моментов времени) рабочего дня (смены), когда производиться отбор проб;
- указание критических точек контроля.
3.2. Забор проб должен быть организованным таким образом, чтобы его влияние на производственный процесс было минимальным.
3.3. Количество контрольных точек устанавливается в зависимости от количества персонала и характера технологических операций, которые осуществляются ними.
3.4. Места расположения контрольных точек в процессе производства устанавливают в местах наиболее вероятных источников микробной контаминации (нижняя часть рукавов, верхняя передняя часть комбинезона (халата) блузона, боковые стороны головного убора и т.д).
3.5. На месте взятия смыва с одежды тампон увлажняют буферным раствором с натрием хлоридом и пептоном рН 7.0, который находиться в пробирке, и тщательно протирают им участок площадью 100 см2, используя трафарет. Одни трафарет используют для взятия одного смыва. Допускается взятие смыва с площади 25 см2 на четырех участках.
3.6. Для взятия смыва с перчаток тампон увлажняют буферным раствором с натрием хлоридом и пептоном рН 7.0, который находиться в пробирке, и тщательно протирают увлажненным тампоном одну перчатку с обеих сторон. Один тампон используется для одной перчатки.
4. Проведение испытаний.
4.1. Испытания осуществляют в лаборатории, придерживаясь правил асептики.
4.2. Каждый тампон тщательно ополаскивают в отдельной пробирке.
4.3. Из каждой пробирки, которая содержит смывную жидкость, делают посев по 1 мл в две чашки Петри с питательной средой для выращивания бактерий и в две с питательной средой для выращивания грибов, используя один из приведенных ниже методов, описанных в ДФУ (раздел 2.6.12) для испытания микробиологической чистоты нестерильных лекарственных средств:
- методом глубинного посева;
- методом двухслойного посева;
4.4. 5 мл смывной жидкости вносят в флакон с 50 мл жидкой питательной средой № 3, описанной в ДФУ (раздел 2.6.13).
4.5. При проведении исследования на присутствие S. aureus и P. aeruginosa 5 мл смывной жидкости вносят в 50 мл соответствующих жидких питательных сред, описанных в ДФУ (раздел 2.6.13).
4.6. Чашка Петри с питательной средой для выращивания бактерий инкубируют при температуре 32.5±2.5 °С, с питательной средой для выращивания грибов при температуре 22.5±2.5 °С на протяжении 5 суток, флаконы со средами № 3 и № 8 при температуре 32.5±2.5 °С на протяжении 48 часов.
4.7. Выполняют контроль стерильности питательных сред. Для этого две чашки Петри и две емкости с жидкой питательной средой, отобранных от каждой партии сред, инкубируют при соответствующей температуры на протяжении 48 часов. После окончания периода инкубации на питательных средах не должно наблюдаться роста микроорганизмов. Контроль стерильности питательных сред осуществляется до начала испытания или одновременно с ним.
4.8. В случае обнаружения роста микроорганизмов в контрольных питательных средах партию питательной среды считают непригодной, а испытание, проведенное с использованием этой партии сред – недействительным. Испытание повторяют на пригодной партии сред.
5. Учет результатов.
5.1. После окончания термина инкубации осуществляют подсчет количества колоний, которые выросли в каждой чашке Петри.
5.2. Для каждого наименования одежды и для перчаток подсчитывают количество колоний во всех чашках Петри с каждой питательной средой, находят среднее арифметической значение и, умножая его на 10, вычисляют количество бактерий или грибов в смыве с площади 100 см2 или одной перчатки.
5.3. При присутствии визуальных признаков роста во всех флаконах с питательной средой № 3 проводят идентификацию бактерий семейства Enterobacteriaсeae по ДФУ (раздел 2.6.13).
5.4. При проведении исследования на присутствие S. aureus и P. aeruginosa идентификацию микроорганизмов осуществляют, используя методы, описанные в ДФУ (раздел 2.6.13) или другой специальной литературе.
5.5. В смывах, взятых с одежды и перчаток после термической обработки, допускается наличие не более 10 микроорганизмов (бактерий и грибов в сумме) на 100 см2 площади поверхности одежды или площади одной перчатки, при отсутствии бактерий семейства Enterobacteriaсeae.
5.6. В смывах, взятых с одежды во время технологического процесса, не допускается присутствие бактерий семейства Enterobacteriaсeae.
5.7. Максимально допустимое количество микроорганизмов (бактерий и грибов в сумме) в смывах с одежды во время производственного процесса устанавливает производитель для каждой технологической операции в зависимости от требований к микробиологической чистоте готовых лекарственных препаратов. Максимально допустимое количество должно быть обосновано при валидации производства.
5.8. В смывах с одежды не допускается присутствие S. aureus и P. aeruginosa.
5.7. Результаты исследований регистрируют.
Директор ДНЦЛЗ В.П. Георгиевский.
академик МИА
УТВЕРЖДЕНО
Приказ МОЗ Украины
14.12. 2001 г. № 502
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО КОНТРОЛЮ МИКРОБИОЛОГИЧЕСКОЙ
ЧИСТОТЫ РУК ПЕРСОНАЛА, КОТОРЫЙ РАБОТАЕТ
В ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЯХ
1.Общие положения.
1.1. Эти методологические рекомендации предлагают порядок проведения контроля микробиологической чистоты рук персонала, который работает в производственных помещениях нестерильных лекарственных препаратов, а именно определение общего количества бактерий, грибов и наличие бактерий семейства Enterobacteriaсeae в смывах, взятых с рук (перчаток) одного работника.
1.2. Задачей контроля является проверка эффективности обработки рук антисептиками и определение микробиологической чистоты рук (перчаток) персонала во время производственного процесса.
1.3. В случае контаминации лекарственного препарата S. aureus или P. aeruginosa проводят контроль микробиологической чистоты рук персонала этими микроорганизмами.
1.4. Контроль эффективности обработки антисептиками рук персонала проводят не реже одного раза на месяц непосредственно после их обработки перед одеванием перчаток, контроль микробиологической чистоты рук (перчаток) персонала во время производственного процесса – не реже одного раза в неделю выборочно у нескольких работников.
1.5. Для контроля эффективности обработки рук и микробиологической чистоты рук (перчаток) персонала используют метод смыва тампонами. Допускается применение других методов при условии их валидации и обоснования максимально допустимого количества микроорганизмов.
1.6. Проверка пригодности методик и возможностей роста питательной среды производиться в соответствии с рекомендациями ДФУ (разделы 2.6.12; 2.6.13).
1.7. Посуда, питательная среда и растворы, которые используются для контроля, должны быть стерильными.
1.8. Персонал, который осуществляет контроль, должен работать в комплекте одежды, предусмотренной для помещений того класса чистоты, где производиться контроль. Персонал должен быть ознакомлен со стандартной рабочей процедурой по микробиологическому контролю рук (перчаток) персонала.
1.9. В производственных помещениях, где осуществляется измельчение и расфасовка лекарственного растительного сырья, которое подлежит термической обработке, контроль микробиологической чистоты рук (перчаток) персонала во время производственного процесса не обязателен.
2. Подготовка к проведению испытания.
2.1. Перед началом испытания приготавливают стерильные ватные тампоны на стеклянных или металлических держателях, пипетки на 1, 2, 5 и 10 мл, чашки Петри и пробирки с 10 мл стерильного буферного раствора с натрия хлоридом и пептоном рН 7.0, описанного в ДФУ(2.6.13). Тампоны могут быть встроены в ватно-марлевые пробки пробирок, которые содержат по 2 мл стерильного буферного раствора с натрия хлоридом и пептоном рН 7.0.
2.2. При необходимости в буферный раствор добавляют соответствующее количество инактиватора, который позволяет эффективно нейтрализовывать антисептики, которые используются для обработки рук.
2.3. Тампоны и, по надобности, пробирки с 10 мл стерильного буферного раствора с натрием хлоридом и пептоном рН 7.0 помещают в бокс.
2.4. Перед передачей боксов с материалами в производственные помещения их внешние поверхности обрабатывают 76 % этиловым спиртом.
2.5. Передачу материалов в помещения с более высоким классом чистоты следует осуществлять через проходные помещения или воздушные шлюзы.
2.6. Для определения роста бактерий используют питательную среду № 1, для определения роста грибов – среду № 2, для определения бактерий семейства Enterobacteriaсeae – среду № 3, которые описаны в ДФУ (раздел 2.6.12 и 2.6.13). Допускается применение других питательных сред, одинаковых по чувствительности и способностям роста.
2.7. Для определения и идентификации S. aureus и P. aeruginosa используются питательные среды и реактивы, которые описаны в ДФУ (раздел 2.6.13), или другие питательные среды, одинаковые по чувствительности и способностям роста.
3. Правила отбора проб.
3.1. Для каждого помещения составляют план отбора проб, который должен включать:
- указание точек отбора проб (контрольных точек);
- указание частоты (периодичности) контроля для каждой точки;
- указание количества проб в каждой точке;
- указание времени (моментов времени) рабочего дня (смены), когда производиться отбор проб;
- указание критических точек контроля.
3.2. Забор проб должен быть организованным таким образом, чтобы его влияние на производственный процесс было минимальным.
3.3. Количество контрольных точек устанавливается в зависимости от количества персонала и характера технологических операций, которые осуществляются ними.
3.4. Контроль микробиологической чистоты рук (перчаток) персонала осуществляется в тех местах, где находятся наиболее вероятные источники микробной контаминации (ладони, межпальцевые пространства, пространства возле ногтя и т.д). Используют по два тампона на одного работника (по одному тампону на каждую руку или рукавичку).
3.5. На месте взятия смыва с одежды тампон увлажняют буферным раствором с натрия хлоридом и пептоном рН 7.0, который находиться в пробирке, и тщательно протирают руки (перчатки) персонала.
4. Проведение испытаний.
4.1. Испытания осуществляют в лаборатории, придерживаясь правил асептики.
4.2. Каждый тампон тщательно ополаскивают в отдельной пробирке, которая содержит 10 мл буферного раствора с натрием хлоридом и пептоном рН 7.0.
4.3. Из каждой пробирки, которая содержит смывную жидкость, делают посев по 1 мл в две чашки Петри с питательной средой для выращивания бактерий и в две с питательной средой для выращивания грибов, используя один из приведенных ниже методов, описанных в ДФУ (раздел 2.6.12) для испытания микробиологической чистоты нестерильных лекарственных средств:
- метод глубинного посева;
- метод двухслойного посева;
4.4. 5 мл смывной жидкости вносят во флакон с 50 мл жидкой питательной средой № 3, описанной в ДФУ (раздел 2.6.13).
4.5. При проведении исследования на присутствие S. aureus и P. aeruginosa 5 мл смывной жидкости вносят в 50 мл соответствующих жидких питательных сред, описанных в ДФУ (раздел 2.6.13).
4.6. Чашки Петри с питательной средой для выращивания бактерий инкубируют при температуре 32.5±2.5 °С, с питательной средой для выращивания грибов при температуре 22.5±2.5 °С на протяжении 5 суток, флаконы со средами № 3 и № 8 при температуре 32.5±2.5 °С на протяжении 48 часов.
4.7. Выполняют контроль стерильности питательных сред. Для этого две чашки Петри и две емкости с жидкой питательной средой, отобранных от каждой партии сред, инкубируют при соответствующей температуры на протяжении 48 часов. После окончания периода инкубации на питательных средах не должно наблюдаться роста микроорганизмов. Контроль стерильности питательных сред осуществляется до начала испытания или одновременно с ним.
4.8. В случае обнаружения роста микроорганизмов в контрольных питательных средах партию питательной среды считают непригодной, а испытание, проведенное с использованием этой партии сред – недействительным. Испытание повторяют на пригодной партии сред.
5. Учет результатов.
5.1. После окончания инкубации осуществляют подсчет количества колоний, которые выросли в каждой чашке.
5.2. Для каждого смыва с одной руки подсчитывают количество колоний во всех чашках Петри с каждой питательной средой, находят среднее арифметической значение и, умножая его на 10, вычисляют количество бактерий или грибов в смыве с одной руки.
5.3. При присутствии визуальных признаков роста в флаконах с питательной средой № 3 проводят идентификацию бактерий семейства Enterobacteriaсeae по ДФУ (раздел 2.6.13).
5.4. При проведении исследования на присутствие S. aureus и P. aeruginosa идентификацию микроорганизмов осуществляют, используя методы, описанные в ДФУ (раздел 2.6.13) или другой специальной литературе.
5.5. После обработки рук антисептиками в смывах с рук не должно быть жизнеспособных микроорганизмов.
5.6. Во время производственного процесса в смывах с рук (перчаток) не допускается присутствие бактерий семейства Enterobacteriaсeae.
5.7. Максимально допустимое количество микроорганизмов (бактерий и грибов в сумме) в смывах с рук (перчаток) во время производственного процесса устанавливает производитель для каждой технологической операции в зависимости от требований к микробиологической чистоте готовых лекарственных препаратов. Максимально допустимое количество должно быть обосновано при валидации производства.
5.8. В смывах с рук (перчаток) персонала не допускается присутствие S. aureus и P. aeruginosa.
5.7. Результаты исследований регистрируют.
Директор ДНЦЛЗ В.П. Георгиевский.
академик МИА
УТВЕРЖДЕНО
Приказ МОЗ Украины
14.12. 2001 г. № 502
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО КОНТРОЛЮ МИКРОБИОЛОГИЧЕСКОЙ ЧИСТОТЫ
МАТЕРИАЛОВ ДЛЯ ПЕРВИЧНОЙ УПАКОВКИ
1.Общие положения.
1.1. Эти методологические рекомендации предлагают порядок проведения контроля микробиологической чистоты материалов для первичной упаковки, которая используется в производстве нестерильных медицинских средств, а именно определение общего количества бактерий и грибов в смывах, которые взяты с внешней поверхности одной единицы первичной упаковки (флакон, труба и др.) или 100 см2 площади поверхности бумаги с полимерным покрытием (или контурной ячеечной упаковки из пленки поливинилхлоридной и фольги алюминиевой), с 10 пробок или с 1.0 г ваты.
1.2. Задачей контроля является проверка эффективности термической обработки и определение микробиологической чистоты во время производственного процесса материалов для первичной упаковки и закупорочных материалов.
1.3. В случае контаминации лекарственного препарата бактериями семейства Enterobacteriaсeae, S. aureus и P. aeruginosa, проводят контроль микробиологической чистоты материалов для первичной упаковки этими микроорганизмами.
1.4. Контроль микробиологической чистоты материалов для первичной упаковки осуществляется по каждой партии упаковки до начала фасовки или разлива и во время производственного процесса. Один раз на две недели проводиться контроль непосредственно после термической обработки и охлаждения материалов для первичной упаковки и закупорочных материалов.
1.5. Для контроля микробиологической чистоты материалов для первичной упаковки используется метод споласкивания или метод смыва тампонами. Допускается применение других методов при условии их валидации и обоснования максимально допустимого количества микроорганизмов.
1.6. Проверка растущих возможностей питательной среды производиться в соответствии с рекомендациями ДФУ (разделы 2.6.12; 2.6.13).
1.7. Посуда, питательная среда и растворы, которые используются для контроля, должны быть стерильными.
1.8. Персонал, который осуществляет контроль, должен работать в комплекте одежды, предусмотренной для помещений того класса чистоты, где производиться контроль. персонал должен быть ознакомлен со стандартной рабочей процедурой по микробиологическому контролю материалов для первичной упаковки.
2. Подготовка и проведение испытания.
2.7. Перед началом испытания приготавливают стерильные колбы емкостью 100-500 мл, чашки Петри, пипетки на 1, 2, 5 и 10 мл, пинцеты, ножницы, емкости с крышками для отбора образцов, пробирки с 10 мл буферного раствора с натрия хлоридом и пептоном рН 7.0, описанного в ДФУ(2.6.13), колбы емкостью 100-500 мл, которые содержат по 10 и 20 мл буферного раствора с натрия хлоридом и пептоном рН 7.0, трафареты размером 10х10 см, ватные тампоны на стеклянных или металлических держателях. Тампоны могут быть встроены в ватно-марлевые пробки пробирок.
2.8. Тампоны, пинцеты, емкости для отбора образцов, трафареты и, по необходимости, пробирки с 10 мл буферного раствора с натрия хлоридом и пептоном рН 7.0 помещают в бокс.
2.9. Перед передачей боксов с материалами в производственные помещения их внешние поверхности обрабатывают 76 % этиловым спиртом.
2.10. Передачу материалов в помещения с более высоким классом чистоты следует осуществлять через проходные помещения или воздушные шлюзы.
2.11. Для определения роста бактерий используют питательную среду № 1, для определения роста грибов – среду № 2, которые описаны в ДФУ (раздел 2.6.12). Допускается применение других питательных сред, одинаковых по чувствительности и способностям роста.
2.12. Для определения и идентификации бактерий семейства Enterobacteriaсeae, S. aureus и P. aeruginosa используются питательные среды и реактивы, которые описаны в ДФУ (раздел 2.6.13), или другие питательные среды, одинаковые по чувствительности и способностям роста.
3. Правила отбора проб.
3.1. Испытание материалов для первичной упаковки и закупорочных материалов, которые изготовлены из стекла и полимерных материалов.
3.1.1. Из каждой партии емкостью не более 10000 единиц выбирают по 10 флаконов (туб, пробок и т.д.). При большей емкости партии выбирают по одной единице от каждых следующих 10000.
3.1.2. Отбор производится при помощи стерильного пинцета в стерильной емкости с крышкой.
3.1.3. С внутренней поверхности каждого флакона (тубы) делаются смывы путем споласкивания его (ее) 10 мл стерильного буферного раствора с натрия хлоридом и пептоном рН 7.0, придерживаясь правил асептики.
3.1.4. 10 пробок (колпачков) помещают, придерживаясь правил асептики, в стерильную колбу емкостью от 100 до 250 мл (в зависимости от размера пробки), которая содержит от 10 до 20 мл стерильного буферного раствора с натрием хлоридом и пептоном рН 7.0, и встряхивают на протяжении 30 сек.
3.2. Испытание контурной ячеечной, контурной безъячеечной упаковки или фольги.
3.2.1. На месте взятия смыва увлажняют тампон фосфатным буферным раствором, который находиться в пробирке, и тщательно протирают им участок площадью 100 см2, используя трафарет. Одни трафарет используют для взятия одного смыва.
3.2.2. В случае, если взять смыв с площади 100 см2 не возможно, допускается взятие смыва одним тампоном с площади 25 см2 в четырех точках.
3.3. Испытание ваты.
3.3.1. Из каждой партии ваты, которая прошла термическую обработку, отбирают не менее трех упаковок.
3.3.2. От каждой упаковки, придерживаясь правил асептики, отбирают образец весом 1.0 г. Помещают его в колбу с 10 мл стерильного буферного раствора с натрием хлоридом и пептоном рН 7.0 и встряхивают на протяжении 30 сек.
4. Проведение испытаний.
4.1. Испытания осуществляют в лаборатории, придерживаясь правил асептики.
4.2. Каждый тампон тщательно ополаскивают в пробирке, которая содержит 10 мл стерильного буферного раствора с натрия хлоридом и пептоном рН 7.0.
4.3. Из каждой пробирки (колбы, флакона), которая содержит смывную жидкость, делают посев по 1 мл в две чашки Петри с питательной средой для выращивания бактерий и в две с живительной средой для выращивания грибов, используя один из приведенных ниже методов, описанных в ДФУ (раздел 2.6.12) для испытания микробиологической чистоты нестерильных лекарственных средств:
- метод глубинного посева;
- метод двухслойного посева;
4.4. Чашка Петри с живительной средой для выращивания бактерий инкубируют при температуре 32.5±2.5 °С, с питательной средой для выращивания грибов при температуре 22.5±2.5 °С на протяжении 5 суток.
4.5. При проведении исследования на присутствие бактерий семейства Enterobacteriaсeae, S. aureus и P. aeruginosa по 5 мл смывной жидкости вносят в 50 мл соответствующих жидких питательных сред, описанных в ДФУ (раздел 2.6.13), и инкубируют при температуре 32.5±2.5 °С на протяжении 48 часов.
4.6. Выполняют контроль стерильности питательных сред. Для этого две чашки Петри и две емкости с жидкой питательной средой, отобранных от каждой партии сред, инкубируют при соответствующей температуре на протяжении 48 часов. После окончания периода инкубации на питательных средах не должно наблюдаться роста микроорганизмов. Контроль стерильности питательных сред осуществляется до начала испытания или одновременно с ним.
4.7. В случае обнаружения роста микроорганизмов в контрольных питательных средах партию питательной среды считают непригодной, а испытание, проведенное с использованием этой партии сред – недействительным. Испытание повторяют на пригодной партии сред.
5. Учет результатов.
5.1. После окончания термина инкубации осуществляют подсчет количества колоний, которые выросли в каждой чашке Петри.
5.2. Для каждого смыва с одного образца материалов для первичной упаковки или закупорочных материалов (одного флакона, тубы, 10 пробок или 100 см2 контурной ячеечной, контурной безъячеечной упаковки, фольги и 1.0 г ваты) подсчитывают количество колоний на всех чашках Петри с каждой питательной средой, находят среднее арифметической значение и, умножая его на 10, вычисляют количество бактерий или грибов в смыве с одного образца.
5.3. После термической обработки материалов для первичной упаковки, закупорочных материалов и ваты в смывах не должно находится жизнеспособных микроорганизмов.
5.4. При проведении исследования на присутствие бактерий семейства Enterobacteriaсeae, S. aureus и P. aeruginosa идентификацию микроорганизмов осуществляют, используя методы, описанные в ДФУ (раздел 2.6.13) или другой специальной литературе.
5.5. Максимально допустимое количество микроорганизмов (бактерий и грибов в сумме) в смывах с материалов для первичной упаковки и закупорочных материалов до начала упаковки или разлива и во время производственного процесса устанавливает изготовитель для каждой технологической операции в зависимости от требований к микробиологической чистоте готовых лекарственных препаратов. Максимально допустимое количество должно быть обосновано при валидации производства.
5.6. В смывах с материалов для первичной упаковки, закупорочных материалов и ваты не допускается присутствие бактерий семейства Enterobacteriaсeae, S. aureus и P. aeruginosa.
5.7. Результаты исследований регистрируют.
Директор ДНЦЛЗ В.П. Георгиевский.
УТВЕРЖДЕНО
Приказ МОЗ Украины
14.12. 2001 г. № 502
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО ПРИГОТОВЛЕНИЮ И ПРИМЕНЕНИЮ
РАБОЧИХ РАСТВОРОВ МОЮЩИХ, ДЕЗИНФЕКЦИОННЫХ,
МОЮЩЕ-ДЕЗИНФЕКЦИОННЫХ СРЕДСТВ И АНТИСЕПТИКОВ
Эти методические рекомендации согласованы с Украинским центром государственного санэпиднадзора МОЗ Украины. Вывод № 04.0.51 государственной санитарно-гигиенической экспертизы, утвержденный заместителем Главного государственного санитарного врача Украины М.А. Ситенко от 25.12.2000 г.
1. Общие положения.
1.1. Эти методические рекомендации предлагают порядок приготовления и использования рабочих растворов моющих, дезинфицирующих, моюще-дезинфицирующих средств и антисептиков с целью использования их для санитарной обработки (мытья и дезинфекции) помещений, технологического оборудования, коммуникаций, внутрицеховой тары, инвентаря, санитарно-технического оборудования и т.д., а также антисептической обработки рук.
1.2. Допускается использование моющих, дезинфицирующих, моюще-дезинфицирующих средств и антисептиков, которые в установленном порядке зарегистрированы в Украине и разрешены для использования на предприятиях химико-фармацевтической промышленности.
1.3. Запрещается использовать органические растворители как моющие средства, а также для приготовления рабочих растворов моющих, дезинфицирующих, моюще-дезинфицирующих средств.
1.4. При использовании моюще-дезинфицирующих средств объединяют стадии мытья и дезинфекции объекта в одну операцию (исключают использование растворов моющих средств).
1.5. Рекомендуется чередовать дезинфицирующие и антисептические средства каждые 1-3 месяца с целью предотвращения развития и распространения стойких вариантов микроорганизмов.
1.6. Для мытья рабочих поверхностей технологического оборудования, коммуникаций, инвентаря и внутрицеховой тары, загрязненных органическими материалами (белки, аминокислоты, антибиотики, ферментные препараты и т.п.), рекомендуется использовать моющие средства, в состав которых введены протеолитичные ферменты, которые расщепляют белки и хорошо удаляют белково-жировую пленку с поверхности оборудования.
1.7. Растворы моющих, дезинфицирующих, моюще-дезинфицирующих средств используются один раз (они не подлежат повторному использованию).
1.8. Отработанные растворы моющих, дезинфицирующих, моюще-дезинфицирующих средств сливают в канализационную систему в соответствии с условиями, которые разрабатываются для каждого предприятия отдельно, исходя из максимально допустимых концентраций компонентов моющих, дезинфицирующих, моюще-дезинфицирующих средств в воде водных объектов хозяйственно-питьевого и культурно-бытового водопотребления.
1.9. Слив в канализационную систему растворов моющих, дезинфицирующих, моюще-дезинфицирующих средств, компоненты которых не нормированы в воде водных объектов хозяйственно-питьевого и культурно-бытового водопотребления, запрещается.
2. Характеристика моющих средств.
2.1. Как моющие средства используются щелочные (кальцинированная сода, каустическая сода) и кислотные (азотная, фосфорная, соляная, уксусная, сульфаминовая кислота) моющие средства, а также моющие средства на основе синтетических поверхностно-активных веществ (синтетические порошки типа А, Б, В, ТЕА-АБСК) и моющие средства с протеолитическими ферментами («Биомой»).
2.2. Моющие средства должны отвечать следующим требованиям:
- проявлять высокую моющую способность;
- обеспечивать полное смачивание поверхностей из разных конструкционных материалов;
- обеспечивать смягчение жесткой воды;
- обеспечивать полное удаление механического, белкового и жирового загрязнения путем их диспергирования и эмульгирования;
- обеспечивать нейтрализацию кислых загрязнений и омыливания жиров (для щелочных моющих средств);
- проявлять низкую агрессивность относительно конструкционных материалов, которые используются для изготовления технологического оборудования, коммуникаций, инвентаря и внутрицеховой тары предприятий химико-фармацевтической промышленности.
2.3. После мытья объектов одним из выше перечисленных моющих средств необходимо полностью удалить остатки загрязнений и раствора моющих средств с обработанных поверхностей при помощи промывания объекта водой.
2.4. Кальцинированная сода представляет собой обезвоженный углекислый натрий (NА2СО3). Имеет вид белого мелкокристаллического порошка, который хорошо растворяется в воде. В водных растворах кальцинированная сода частично растворяется с образованием едкой щелочи и гидрокарбоната, которые обуславливают моющие способности. Горячие (55±5) °С растворы кальцинированной соды хорошо обмыливают жировые загрязнения на поверхностях и разрушают белки. При уменьшении температуры растворов до (45±5) °С их моющая способность резко падает. Растворы кальцинированной соды коррозируют объекты, которые изготовлены из алюминия.
Средство относиться к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007). В нативном виде и концентрированных растворах раздражает кожу и слизистую оболочку глаз.
Гарантийный срок хранения 1 год от даты производства. Хранят в упаковке производителя в укрытых складских помещениях.
Рекомендуется использовать 0,5 % раствор кальцинированной соды температурой (45±5) °С для ручного мытья технологического оборудования и инвентаря, а также (1-2) % растворы температурой (55±5) °С для циркуляционного мытья технологического оборудования и коммуникаций.
Растворы кальцинированной соды не предназначены для мытья оборудования, коммуникаций и инвентаря, которые изготовлены из алюминия.
2.5. Каустическая сода (едкий натр NаОН) представляет собой бесцветное кристаллическое вещество. Гигроскопическая. Хорошо растворяется в воде. Водные растворы имеют щелочную реакцию. Горячие (1-2) % растворы каустической соды хорошо обмыливают жиры, гидролизируют белки, расщепляют углеводы. При уменьшении температуры раствора моющие способности средства падают. Растворы каустической соды коррозируют объекты, которые изготовлены из алюминия.
Средство относиться к высоко опасным веществам (2 класс опасности по ГОСТ 12.1.007). При попадании на кожу вызывает химический ожог. Раздражает слизистую оболочку глаз и верхних дыхательных путей.
Гарантийный срок хранения 1 год от даты производства. Хранят в упаковке производителя в складских неотапливаемых помещениях.
Рекомендуется использовать 0,5 % раствор каустической соды температурой (45±5) °С для ручного мытья технологического оборудования и инвентаря, а также (1-2) % растворы температурой (55±5) °С для циркуляционного мытья технологического оборудования и коммуникаций.
Растворы каустической соды не предназначены для мытья оборудования, коммуникаций и инвентаря, которые изготовлены из алюминия.
2.6. Средство моющее техническое синтетического типа А, Б, В представляет собой много компонентную смесь, которая содержит сульфонол, триполифосфат натрия, соду кальцинированную, сульфат натрия.
Промышленность производит синтетический моющий порошок трех типов для воды разной жесткости (ТУ У 22920528.002-2000 «Средство моющее техническое синтетическое». Изготовитель – предприятие «ДЕЛАНА», г. Киев):
- тип А предназначен для использования в районах с жесткостью воды выше 5.35 мг-екв (15˚ нем);
- тип Б предназначен для использования в районах с жесткостью воды от 2.0 кг-екв до 5.35 мг-екв (от 6˚ нем до 15˚ нем);
- тип В предназначен для использования в районах с жесткостью воды не выше 2.0 кг-екв (не выше 6˚ нем);
Порошки типа А и Б предотвращают образование осадка в жесткой воде.
Синтетические моющие порошки типа А, Б, В не коррозируют объекты, которые изготовлены из нержавеющей стали, стекла, эмали, кафеля, черного метала с антикоррозийным покрытием, алюминия.
Средство относиться к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007). В сухом виде и концентрированных растворах раздражает кожу и слизистую оболочку глаз.
Рекомендуется использовать 0,5 % раствор синтетического моющего порошка типа А, Б, В температурой (45±5) °С для ручного мытья технологического оборудования и инвентаря, а также 1 % раствор температурой (55±5) °С для циркуляционного мытья технологического оборудования и коммуникаций.
2.7. ТЕА-АБСК (триетаноламиновая соль алкилбензолсульфокислоты) – синтетическое поверхностно-активное вещество. Представляет собой вязкое вещество светло-коричневого цвета. Водные растворы проявляют моющие способности. ТЕА-АБСК не коррозирует изделия из металла, стекла, кафеля, резины, полимерных материалов.
Средство относиться к слабо опасным веществам (4 класс опасности по ГОСТ 12.1.007). Раздражает кожу и слизистую оболочку глаз, проявляет умеренные кумулятивные способности.
Гарантийный срок хранения 2 года от даты производства. Хранят в упаковке производителя в крытых складских помещениях. Допускается хранение средства под наметом на открытых площадках при температуре внешней среды. В случаях замерзания средства его перед сливом выдерживают при температуре от 20 до 50˚С до полного размораживания. При этом способности продукта сохраняются.
Рекомендуется использовать 0.1 – 10.0 % растворы ТЕА-АБСК для мытья оборудования и инвентаря. Концентрация рабочих растворов зависит от степени загрязнения объектов. Рабочие растворы приготавливают перед использованием.
2.8. Биомой – моющее средство, которое содержит синтетические поверхностно-активные вещества и протеолитические ферменты (щелочная фосфатаза). Представляет собой порошок светлого цвета (от белого до светло-желтого), который имеет умеренный запас использованного сырья. Растворимость в воде составляет не менее 30 г/дм3 при 20 ˚С. Водные растворы биомой бесцветные, прозрачные, проявляют моющие, эмульгирующие и диспергирующие способности, легко удаляют белково-жировую пленку с поверхностей технологического оборудования, легко смываются, не оставляют налета. В отличии от других моющих средств, биомой проявляет большую моющую активность при температуре не выше (40±5) °С. Растворы биомоя не повреждают объекты из нержавеющей стали, черного металла с антикоррозийным покрытием, алюминия, стекла, резины, полимерных материалов, кафеля, эмали. Несовместимы с катионными поверхностно-активными веществами.
Средство относиться к слабо опасным веществам (4 класс опасности по ГОСТ 12.1.007), не проявляет кумулятивных, коже-резорбтивных и алергенных способностей. В сухом виде раздражает кожу и слизистую оболочку глаз.
Гарантийный срок хранения 1 год от даты производства. Хранят в упаковке производителя в крытых складских помещениях, которые проветриваются и не доступны для общего использования.
Рекомендуется 0.5 % раствор биомоя температурой (40±5) °С для ручного мытья технологического оборудования, стеклянной и полимерной тары и инвентаря, а также (0.15 – 0.3) % растворы температурой (40±5) °С для циркуляционного мытья технологического оборудования и коммуникаций и мытья стеклянной и полимерной тары.
2.9. С целью удаления осадков, которые образуются на внутренних поверхностях технологического оборудования и трубопроводов, используют кислотные моющие средства в виде разбавленных растворов неорганических и органических кислот (азотная, фосфорная, соляная, уксусная, сульфаминовая кислота). Кислотные моющие средства рекомендуются к использованию после мытья оборудования и трубопроводов растворами щелочных моющих средств.
3. Характеристика дезинфицирующих, моюще-дезинфицирующих средств и антисептиков.
3.1. Для проведения дезинфицирующих мероприятий используются дезинфицирующие средства, которые содержат в себе в качестве активного действующего вещества (далее в тексте АДВ) окислители (перекись водорода), глутаровый альдегид (корзолин иД), глутаровый альдегид в смеси с четвертинными аммонийными соединениями (деконекс 50 ФФ), производные гуанидина (гембар), и моюще-дезинфицирующие средства, которые содержат в качестве АДВ хлоропроизводные гидантоина (дезактин, хлорантоин). Допускается использование других моющих средств, которые отвечают требованиям п.1.2.
3.2. Для проведения антисептической обработки рук используются антисептические средства, которые содержат в качестве АДВ 1-пропанол, 2-пропанол, октенидиндигидрохлорид (октенидрем), феноксиэтанол (октенисепт), 1-пропанол, 2-пропанол, молочную кислоту (сагросепт). Допускается использование других антисептических средств, которые отвечают требованиям п.1.2.
3.4. Дезинфицирующие и моюще-дезинфицирующие средства должны обеспечить обеззараживание поверхностей рабочих помещений, оборудования, инвентарь от патогенных и сапрофитных микроорганизмов.
3.5. Антисептические средства должны обеспечивать гибель патогенных и сапрофитных микроорганизмов на коже рук персонала.
3.6. Растворы дезинфицирующих и моюще-дезинфицирующих средств используют после тщательного мытья объектов, поскольку остатки сырья, полуфабрикатов, готовой продукции или моющих средств понижает эффективность обеззараживания объектов.
3.7. Дезактин – дезинфицирующее средство с моющим эффектом производства ООО «ДЕЛАНА» (Украина). В качестве АДВ содержит дихлорантин. В состав средства включены анионы поверхностно-активных веществ, диспергатор, наполнитель. Представляет собой порошок от белого до желтоватого цвета со слабым запахом хлора. Растворимость в воде не менее 20 мг/дм. Для ускорения растворения дезактину допускается использование теплой воды при температуре (40±5) °С.
Водные растворы дезактина прозрачные, бесцветные, имеют умеренный запах хлора. Не коррозируют объекты, которые изготовлены из металла, стекла, резины, полимерных материалов, дерева, кафеля, фарфора, фаянса, а также поверхности технологического оборудования и оснащения с лакокрасочным, полимерным и гальваническим покрытием, не фиксируют белковые и жировые загрязнения на обработанных поверхностях, проявляют увлажняющие и моющие способности, хорошо смываются.
Средство относиться к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007). Не проявляет кумулятивных, коже-раздражающих, сенсибилизирующих способностей. В сухом виде и концентрированных растворах раздражает слизистую оболочку глаз.
Гарантийный срок хранения 3 года от даты производства. Хранят в упаковке производителя в крытых складских помещениях не более чем в 3 яруса вдали от источников открытого огня и тепла.
Дезактин проявляет бактерицидные, туберкулоцидные и фунгицидные способности.
Рекомендуется использовать: 0.2 % раствор дезактина для текущей дезинфекции поверхностей помещений (стена, пол, окна, двери), уборочного инвентаря, технологического и санитарно-технического оборудования, коммуникаций, инвентаря и внутрицеховой тары; 1.0 % раствор дезактина – для дезинфекции объектов, которые контаминированы Mycobacterium tuberculosis; 2.0 % раствор дезактина – для дезинфекции объектов, которые контаминированы плесневыми грибами.
3.8. Деконекс 50 ФФ - дезинфицирующее средство производства фирмы «Borer Chemie AG» (Швейцария). В качестве АДВ содержит глиоксаль, глутаровый альдегид, дидецилдиметиламонийхлорид. В состав вещества введены гликоли, смесь эфирных масел и воды. Представляет собой вязкую жидкость зелено-голубого цвета с характерным запахом отдушки. Хорошо растворяется в воде. Для приготовления рабочих растворов деконекса 50 ФФ используют холодную воду (при использовании горячей воды могут испариться отравляющие пары альдегидов).
Водные растворы деконекса 50 ФФ прозрачные, закрашены в зеленый цвет, имеют моющие способности. Не коррозируют объекты, которые изготовлены из металла, стекла, полимерных материалов и резины, легко смываются, не оставляя налета.
Средство относиться к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007). В нативном виде и концентрированных растворах раздражает кожу, слизистую оболочку глаз и верхние дыхательные пути. Не проявляет сенсибилизирующих и канцерогенных способностей.
Гарантийный срок хранения 5 лет от даты производства. Хранят в упаковке производителя в крытых складских помещениях, которые не доступны для общего пользования, при температуре от 5 до 30 ˚С.
Деконекс проявляет бактерицидные, включая туберкулоцидные, фунгицидные и вирулицидные способности.
Рекомендуется использовать 0.25, 0.5 и 1.0 % растворы деконекса 50 ФФ для текущей дезинфекции поверхностей помещений (стена, пол, окна, двери), уборочного инвентаря, технологического и санитарно-технического оборудования, коммуникаций, инвентаря и внутрицеховой тары.
3.9. Гембар - дезинфицирующее средство производства фирмы НВЦ «Биоцид» (Украина). В качестве АДВ содержит полигексаметиленгуанидин фосфат. Представляет собой бесцветную или прозрачную желтоватую жидкость. Не имеет запаха. Хорошо растворяется в воде. Не вредит материалам, изготовленным из металла, стекла, полимерных материалов и резины. После высыхания раствора на обработанных поверхностях образуется пленка.
Средство относиться к слабо опасным веществам (4 класс опасности по ГОСТ 12.1.007), не раздражает кожу, не проявляет коже-резорбтивных, сенсибилизирующих, кумулятивных, мутагенных и канцерогенных способностей. Раздражает слизистую оболочку глаз.
Гарантийный срок хранения 2 года от даты производства. Хранят в плотно закрытых емкостях при комнатной температуре в местах, недоступных для общего использования.
Гембар проявляет бактерицидные и вирулицидные способности.
Рекомендуется использовать 5.0 % растворы гембара для текущей дезинфекции поверхностей помещений (стена, пол, окна, двери), уборочного инвентаря и санитарно-технического оборудования.
3.10. Корзолин иД – дезинфекционное средство производства фирмы «BODE Chemie GmbH & Co.» (Германи). В качестве АДВ содержит глутаровый альдегид. В состав препарата введены тензиды, ингибитор коррозии, активирующие добавки и вода. Представляет собой прозрачную жидкость желтого цвета. Не имеет специфического запаха.
Хорошо растворяется в воде и этиловом спирте. Для приготовления рабочих растворов корзолина иД используют холодную воду (при применении горячей воды возможно испарение ядовитых паров альдегидов).
Водные растворы корзолина иД прозрачные, умеренно окрашены в жёлтый цвет, не имеют запаха. Растворы корзолина иД легко смываются, не оставляя налёта, не наносят вреда объектам, из металла, фарфора, стекла, резины, полимерных материалов.
Средство относят к умеренно опасным веществам при введении в желудок лабораторных животных (3 класс опасности по ГОСТ 12.1.007). Раздражает кожу, слизистую оболочку глаз и верхних дыхательных путей. Не проявляет сенсибилизирующих и канцерогенных свойств.
Гарантийный срок хранения 3 года с момента изготовления. Хранить в упаковке производителя в крытых складских помещениях, недоступных для общего пользования, отдельно от источников открытого огня и тепла.
Корзолин иД наделён бактерицидными, туберкулецидными, фунгицидные, спороцидными и вирулецидные свойствами.
Рекомендуется использовать 4,0 и 10,0 % раствора корзолина иД для дезинфекции инвентаря и инструментов. Раствор корзолина иД 4,0 % концентрации сохраняют активность на протяжении 10 дней, 10,0 % концентрации - 14 дней с момента приготовления в ёмкостях с плотно закрывающимися крышками.
3.11.Октенидерм - средство для гигиенической дезинфекции кожи рук производства фирмы "Schulke & Mayr" (Германия). Октенидерм представляет собой бесцветную прозрачную жидкость с умеренным запахом изопропилового спирта. Температура кипения 80 ºС, температура возгорания 23,5 ºС.
Средство относят к малоопасным веществам ( 4 класс опасности по ГОСТ 12.1.007 ) при введении в желудок. Не проявляет кожно-раздражающих и сенсибилизирующих свойств при одно- или многоразовом нанесении на кожу. В нативном виде раздражает слизистую оболочку глаз.
Гарантийный срок хранения 5 лет с момента изготовления. Октенидерм хранят в упаковке производителя в крытых хорошо проветриваемых помещениях ,недоступных для общего пользования, отдельно от источников открытого огня и тепла при температуре от –5 ºС до +40 ºС. При хранении октенидерма необходимо избегать попадания прямого солнечного света на упаковку.
Октенидерм проявляет бактерицидные (включая туберкулецидные), фунгицидные и вирулецидные свойства.
Рекомендуется использовать для гигиенической дезинфекции кожи рук персонала. Средство используют с целью гигиенической дезинфекции кожи в неразбавленном виде путём нанесения на предварительно очищенную кожу до полного её увлажнения с помощью стерильного тампона или распылителя. Экспозиция составляет 1 мин. Персонал должен приступать к работе после полного высыхания октенидерма.
3.12.Октенисепт - средство для гигиенической дезинфекции кожи рук производства фирмы "Schulke & Mayr" (Германия). Октенисепт представляет собой бесцветную прозрачную жидкость без специфического запаха. Температура кипения 100 ºС, температура возгорания >100 ºС.
Октенисепт принадлежит к малоопасным веществам ( 4 класс опасности по ГОСТ 12.1.007 ) при введении в желудок. Не проявляет кожно-раздражающих свойств при одно- или многоразовом нанесении на кожу. В нативном виде раздражает слизистую оболочку глаз.
Гарантийный срок хранения 4 года с момента изготовления. Октенисепт хранят в упаковке производителя в крытых хорошо проветриваемых помещениях ,недоступных для общего пользования, отдельно от источников открытого огня и тепла при температуре от –5 ºС до +40 ºС.
Октенисепт проявляет бактерицидные (включая туберкулецидные), фунгицидные и вирулецидные свойства.
Рекомендуется использовать для гигиенической дезинфекции кожи рук персонала. Октенисепт используют с целью гигиенической дезинфекции кожи в неразбавленном виде путём нанесения на предварительно очищенную кожу до полного её увлажнения с помощью дозатора. Экспозиция составляет от 2 до 5 мин. Персонал должен приступать к работе после полного высыхания октенисепта.
3.13.Перекись водорода медицинская (Н2О2) по ГОСТ-117 представляет собой бесцветную прозрачную жидкость, содержащую 30-40 % АДВ. Перекись водорода стабилизируют не более 0,6 г/дм3 пирофосфорнокислым натрием или однозамещённым фосфорнокислым натрием. Температура замерзания перекиси водорода с массовой долей АДВ 30 % составляет 25,7 ºС, с массовой долей АДВ 40 % составляет -41,4 ºС.
Перекись водорода - не горящая пожаровзрывоопасная жидкость, сильный окислитель. Разлагается на воду и кислород, смешивается с водой в любом соотношении. Как средство пожарогашения используют сильную струю воды.
Перекись водорода повреждает объекты из железа, хрома, свинца, серебра, меди, латуни, марганца, чугуна, нелегированных и низколегированных сталей. Не совмещается со щелочами.
Перекись водорода относят к сверхопасным веществам (2 класс опасности по ГОСТ 12.1.007). Раздражает кожу, слизистую оболочку глаз и верхних дыхательных путей.
Гарантийный срок хранения 6 месяцев с момента изготовления. Хранить в складских помещениях ,обеспечивающих защиту от попадания солнечных лучей , при температуре не выше 30 ºС. Допускается хранение перекиси водорода на открытых площадках, оснащённых навесом, исключающим попадание прямых солнечных лучей, в складских ёмкостях с изотермическим устройством, обеспечивающим температуру не выше +30ºС и не ниже -30ºС.
Перекись водорода проявляет бактерицидные, вирулецидные и спороцидные свойства. Используют для дезинфекции в смеси с 0,5 % синтетического моющего средства ("Лотос").
Рекомендуется использовать 1,0; 3,0 и 4,0 % перекиси водорода для текущей дезинфекции технологического оборудования, коммуникаций, инвентаря и внутрицеховой тары, контаминированных споровыми формами микроорганизмов.
3.14. Рецептура С-4 - смесь растворов перекиси водорода и муравьиная кислоты, при взаимодействии которых образуется сверхмуравьиная кислота.
Рецептура С-14 оказывает бактерицидное и спороцидное действие.
Рекомендуется использовать раствор с массовой частью сверхмуравьиная кислоты 2,4 % для антисептической обработки рук персонала.
Приготовленный раствор рецептуры С-14 можно хранить не более 1 дня в герметически закрытой стеклянной посуде в прохладном месте.
3.15. Сагросепт - средство для гигиенической дезинфекции кожи рук производства фирмы "Schulke & Mayr" (Германия). Представляет собой прозрачную жидкость голубого цвета с умеренным запахом изопропилового спирта. Температура кипения 80 ºС, температура возгорания 24 ºС.
Сагросепт принадлежит к малоопасным веществам (4 класс опасности по ГОСТ 12.1.007) при введении в желудок и нанесении на кожу. Не проявляет коже-раздражающих и сенсибилизирующих свойств при одно- или многоразовом нанесении на кожу. В нативном виде раздражает слизистую оболочку глаз.
Гарантийный срок хранения 5 лет с момента изготовления. Хранят в упаковке производителя в крытых, хорошо проветриваемых помещениях ,недоступных для общего пользования, отдельно от источников открытого огня и тепла при температуре от –5 ºС до +40 ºС. При хранении сагросепта необходимо избегать прямого попадания солнечных лучей на упаковку.
Сагросепт оказывает бактерицидные, (включая туберкулецидные), фунгицидные и вирулецидные свойства.
Рекомендуется использовать для гигиенической дезинфекции кожи рук путём нанесения на предварительно очищенную кожу до полного её увлажнения с помощью распылителя. Экспозиция составляет 1 мин. Персонал должен приступать к работе после полного высыхания сагросепта.
3.16. Спирт этиловый - бесцветная жидкость с характерным запахом. Принадлежит к быстро возгорающимся жидкостям. Категория и группа взрывоопасной смеси спирта с воздухом ІІА-Т2 в соответствии с ГОСТ 12.1.011. Во время работы со спиртом этиловым должны применяться герметические аппараты, оборудование и герметическая транспортная тара.
Средство принадлежит к малоопасным веществам (4 класс опасности по ГОСТ 12.1.007.).Не оказывает кожно-раздражающих свойств при однократном нанесении на кожу. Раздражает слизистую оболочку глаз. Вызывает сухость кожи при многоразовых аппликациях.
Транспортировка и хранение спирта этилового должны соответствовать требованиям ГОСТ 5962.
Оказывает гермистатические и гермицидные свойства относительно грампозитивных и грамнегативных бактерий и некоторых видов грибов. Не оказывает спороцидного действия.
Рекомендуется использовать 76 % растворы для дезинфекции оборудования и антисептической обработки рук персонала.
3.17. Стерилиум (фирма "BODE Chemie GmbH & Co" ,Германия) - антисептическое средство для гигиенической обработки кожи рук, имеющее пролонгированный антисептический эффект.
Стерилиум проявляет бактерицидные, фунгицидные и туберкулецидные свойства.
Стерилиум используют для антисептической обработки рук персонала. Не имеет негативных последствий при многоразовом использовании.
3.18. Хлорантоин по ТУ У 2902465.004-95 -дезинфекционное средство с моющими свойствами производства НВТ "Фармакос" (Украина). В качестве АДВ содержит дихлорантин. В состав средства введены моющие компоненты, диспергатор, ингибитор коррозии и наполнитель. Представляет собой сыпучий порошок светлых тонов с умеренным запахом хлора. Хлорантоин марки Т выпускают в форме таблеток.
Растворимость в воде не меньше 20 мг/дм3. Водные растворы хлорантоина прозрачные, бесцветные, имеют слабый запах хлора, наделены моющими свойствами, не наносят вреда объектам из нержавеющей стали, алюминия, дерева, эмали, фаянса, кафеля, стекла, резины, полимерных материалов, легко смываются, не оставляя налёта. Хлорантоин не совмещается с катионными поверхностно-активными веществами, одно- или многоатомными спиртами.
Средство относят к умеренно опасным веществам при ингаляционном попадании в организм (3 класс опасности по ГОСТ 12.1.007). В сухом виде и концентрированных растворах раздражает слизистую оболочку глаз и верхних дыхательных путей. В рекомендованных к применению концентрациях не обладает кожно-раздражающими, кожно-резорбтивными и сенсибилизирующими свойствами.
Гарантийный срок хранения 3 года с момента изготовления. Хранить в упаковке производителя в крытых складских помещениях не более чем в 3 яруса отдельно от источников открытого огня и тепла.
Хлорантоин проявляет бактерицидные, туберкулецидные, фунгецидные и вирулецидные свойства.
Рекомендуется использовать: 0,2 % раствор хлорантоина для текущей дезинфекции поверхностей помещения (стены, пол, окна, двери), инвентаря для уборки, технологического и санитарно-технического оборудования, коммуникаций, инвентаря и внутрицеховой тары; 1,0 % растворы - для дезинфекции объектов контаминированных Mycobacterium tuberculosis; 2,0% раствора - для дезинфекции объектов, контаминированных плесневыми грибами.
4. Порядок приготовления рабочих растворов моющих, дезинфекционных, моюще-дезинфекционных и антисептических средств
4.1 Рабочие растворы (далее растворы) моющих, дезинфекционных, моюще-дезинфекционных и антисептических средств готовят в специально выделенной маркированной таре из коррозионно-стойких материалов (за исключением эмали) путём интенсивного смешивания с водой. Для приготовления растворов щелочных моющих средств (кальциевая сода, каустическая сода) запрещается использовать тару, изготовленную из алюминия, для приготовления растворов перекиси водорода - тару, изготовленную из низколегированной стали, меди, латуни. Для приготовления рецепта С-4 используют исключительно стеклянные ёмкости.
4.2 Допускается приготовление растворов моющих, дезинфекционных и моюще-дезинфекционных средств непосредственно в технологических ёмкостях и резервуарах, предназначенных для циркуляции растворов, с учётом коррозионной стойкости материалов из которых они изготовлены.
4.3 Для приготовления растворов моющих, дезинфекционных и моюще-дезинфекционных средств и промывания объектов химико-фармацевтической промышленности используют воду очищенную, соответствующую требованиям ФС 42-2619-89.
4.4 Рабочие растворы щелочных и кислотных моющих средств готовят из концентрированных растворов или сухих порошков, придерживаясь следующих правил.
Бочки с сухой каустической содой раскрывают при помощи специального ножа. Большие частицы каустической соды раскалывают в специально отведённом месте, предварительно накрыв их плотной тканью (бельтинг). Части твёрдой щелочи берут с помощью щипцов.
Концентрированные растворы щелочей и кислот кладут в ёмкости после заполнения их водой. Кислоты и щёлочи переливают в ёмкости при помощи сифона или специальной лейки, предотвращающих их разбрызгивание. Концентрированные кислоты или щёлочи разрешается наливать только в чистые вёдра из нержавеющей стали или эмалированные ёмкости в количестве, не превышающем 70 % объёма ведра.
В местах, предназначенных для выполнения работ с концентрированными кислотами и щёлочам, должны хранится соответствующие нейтрализующие средства (раствор соды, аммиака или борной кислоты).
Уборку разлитых кислот и щёлочей производят в противогазе с коробкой "В".
4.5 При приготовлении растворов хлорактивных дезинфекционных средств будет уместным сначала приготовить суспензию препаратов в ограниченном количестве воды, а потом развести суспензию водой до необходимого объёма.
4.6 При приготовлении раствора рецептур С-4 нужное количество ингредиентов смешивают в стеклянной посудине, потом ставят её на 1-1,5 часа в холодную воду, периодически встряхивая.
4.7 При приготовлении раствора перекиси водорода с моющим средством к пероксиду водорода добавляют небольшое количество воды, потом добавляют необходимое количество моющего средства и разводят водой до необходимого объёма.
4.8 Приготовленные растворы моющих, дезинфекционных и моюще-дезинфекционных средств хранят в таре с плотно закрывающейся крышкой. Растворы рецептуры С-4 хранят в герметически закрытых стеклянных ёмкостях.
4.9 Растворы моющих, дезинфекционных, моюще-дезинфекционных и антисептических средств рекомендуется готовить непосредственно перед использованием.
4.10. Допускается хранение неиспользованных растворов щелочных моющих средств (калькиевая сода, каустическая сода) и моющих средств на основе поверхностно-активных веществ (синтетические порошки типа А, Б, В) в течение 14 дней с момента приготовления, моющих средств с протеолитическими ферментами (биомой) - на протяжении 1 дня с момента приготовления, растворов хлорактивных дезинфекционных средств и перекиси водорода - в течение 1 дня с мометна приготовления, растворов дезинфекционных средств из группы четвертинных амониевых соединений - на протяжении 14 дней с момента приготовления, растворов рецептуры С-4 - в течение 1 дня с момента приготовления
4.11. Для приготовления растворов моющих, дезинфекционных и моюще-дезинфекционных средств соответствующей концентрации исходят из расчётов, приведённых в табл.1.
4.12. Для приготовления растворов ТЕА-АБСК соответствующей концентрации исходят из расчётов, приведённых в табл. 2.
4.13. Для приготовления растворов рецептуры С-4 с массовой долей сверхмуравьиной кислоты 2,4 % исходят из расчётов, приведённых в табл. 3.
4.14. Объём пероксида водорода, необходимого для приготовления перосида водорода определённой концентрации, рассчитывают по формуле:
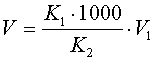 ,
,
где:
V - объём пероксида водорода (cм3);
K1 - нужная концентрация раствора пероксида водорода (%);
K2 - массовая доля пероксида водорода (%);
V1 - нужный объём раствора дезинфекционного средства (дм3).
4.15. Объём спирта этилового, необходимый для приготовления рабочего раствора 76 %, рассчитывают по формуле:
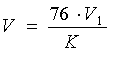 ,
,
где:
V - объём спирта этилового (cм3);
V1 - нужный объём рабочего раствора (см3);
K - концентрация абсолютного спирта в спирте этиловом (%).
4.16. Рекомендации относительно использования моющих, дезинфекционных и моюще-дезинфекционных средств с учётом их свойств и коррозионной стойкости конструкционных материалов приведены в табл. 4.
4.17. Режимы применения моющих средств приведены в табл. 5.
4.18. Режимы применения дезинфекционных и моюще-дезинфекционных средств с целью текущей дезинфекции поверхностей помещений, инвентаря для уборки и санитарно-технического оборудования приведены в табл. 6.
4.19. Режимы применения дезинфекционных и моюще-дезинфекционных средств с целью текущей дезинфекции технологического оборудования и коммуникаций приведены в табл. 7.
4.20. Режимы применения дезинфекционных и моюще-дезинфекционных средств с целью профилактической дезинфекции инвентаря, инструментов и внутрицеховой тары приведены в табл. 8.
4.21. Режимы применения дезинфекционных и моюще-дезинфекционных средств с целью текущей дезинфекции технологического оборудования и коммуникаций, контамированных плесневыми грибами, приведены в табл. 9.
4.22. Режимы применения дезинфекционных и моюще-дезинфекционных средств с целью профилактической дезинфекции поверхностей помещений, контаминированных плесневыми грибами, приведены в табл. 10.
4.23. Режимы применения дезинфекционных и моюще-дезинфекционных средств с целью профилактической дезинфекции поверхностей помещений, контаминированных Mycobacterium tuberculosis, приведены в табл. 11.
5. Методы и средства контроля качества санитарной обработки
5.1. Контроль качества санитарной обработки заключается в определении полноты удаления белкового, жирового и микробного загрязнения, полноты удаления остатков моющих, дезинфекционных и моюще-дезинфекционных средств с обработанных объектов и определения степени содержания компонентов моющих, дезинфекционных и моюще-дезинфекционных средств в воздухе рабочей зоны.
5.2. Полноту удаления жировых загрязнений с поверхности технологического оборудования и инвентаря контролируют путём проведения цветной реакции с помощью судана ІІІ. На небольшой (размером 5х5 см) участок поверхности объекта, который соприкасается с лекарственными средствами на жировой основе и сырья для их изготовления, наносят 1-5 см3 цветного реактива с суданом III. Через 10 с. цветной реактив смывают сильной струёй воды. Жёлтые пятна и потёки говорят о наличии жирового загрязнения. (Приготовление цветного реактива : 0,2 г измельчённого судана III и 0,2 г метиленового синего растворяют в 70 см3 95% спирта этилового, нагретого на водяной бане до температуры 60 ºС . Добавляют 10 см3 20-25 % раствора аммиака и 20 см3 дистилированной воды. Перемешивают. Раствор годен к применению в течение 6 месяцев).
5.3. Полноту удаления остатков щелочных моющих средств (кальциевая сода, каустическая сода) и биомоя с рабочих поверхностей технологического оборудования, инвентаря, коммуникаций, внутрицеховой тары контролируют после промывания объектов водопроводной водой с целью удаления остатков моющих средств путём проведения фенолфталеиновой пробы. Для этого 1-2 капли 1% спиртового раствора фенолфталеина добавляют к 10 см3 последней порции промывочной воды. Розовая окраска говорит о наличии остатков щелочных моющих средств или биомоя на поверхности объекта. Допускается нанесение 1-2 капель 1% спиртового раствора фенолфталеина непосредственно на поверхность контролируемого объекта. Появление розовой окраски свидетельствует о наличии остатков щелочных моющих средств или биомоя на поверхности объекта.
5.4. Допускается контролирование полноты удаления остатков щелочных моющих средств (кальциевая сода, каустическая сода), биомоя и кислотных моющих средств (азотная, фосфорная, соляная, уксусная, сульфаминовая кислоты) с рабочих поверхностей технологического оборудования, инвентаря, коммуникаций, внутрицеховой тары с помощью индикаторной бумаги (ТУ 6-09-1181), имеющей диапазон рН от 1 до 10.
На увлажнённую поверхность исследуемого объекта накладывают индикаторную бумагу и сразу сравнивают её цвет с эталоном цветной шкалы. Изменение цвета от жёлтого до оранжево - красного свидетельствует о наличии остатков кислотных моющих средств, появление сине-фиолетовой окраски - о наличии остатков щелочных моющих средств или биомоя.
5.5. Полноту удаления остатков моющих средств на основе анионных поверхностно-активных веществ (синтетические порошки типа А, Б, В) с рабочих поверхностей технологического оборудования, коммуникаций, инвентаря и внутрицеховой тары контролируют путём определения содержания остаточного количества моющих средств (по остаткам анионных поверхностно-активных веществ) в последней порции промывочной воды.
Наличие анионных поверхностно-активных веществ в промывочной воде определяют путём добавления до 50 см3 последней порции промывочной воды 5 капель 1 % раствора фенолфталеина (при необходимости смесь нейтрализуют 1 моль/дм3 раствором гидроокиси натрия или 5 моль/ дм3 раствором серной кислоты до слабо-розовой окраски) и добавляют 15 см3 хлороформа, 10 см3 смешанного индикатора и 10 0,04 моль/ дм3раствора гиамина 1622. Исчезновение розовой и появление серо-синей окраски говорит о наличии остатков моющих средств на основе анионных поверхностно-активных веществ.
5.6. Полноту удаления остатков дезинфекционных и моюще-дезинфекционных средств с объектов химико-фармацевтической промышленности контролируют путём определения содержания остаточного количества АДВ в последней порции промывочной воды.
5.7. При использовании хлорактивных дезинфекционных и моюще-дезинфекционных средств (дезактин, хлорантоин) используют экспресс-экспериментальный метод определения АДВ (активного хлора) в промывочных водах: последнюю порцию промывочной воды наливают в пробирки на высоту 10 см и доливают в пробирки 0,5 см3 10 % раствора йодистого калия и 0,5 см3 0,5 % раствора крахмала. После перемешивания содержимого пробирок наблюдают на белом фоне окрашивание сверху вниз. Еле заметное посинение соответствует 0, 05 мг остаточного хлора/ дм3 промывочной воды; слегка синеватая окраска - 0,1 мг остаточного хлора/ дм3 промывочной воды; синяя окраска - 0,3 мг остаточного хлора/ дм3 промывочной воды; интенсивная синяя окраска - 0, 5 мг остаточного хлора/ дм3 промывочной воды (дна не видно). Остаточное количество хлора в промывочной воде не должно превышать 0, 5 мг / дм3 .
5.8. Полноту удаления перекиси водорода с поверхности объектов контролируют путём добавления до 1 см3 последней порции промывочной воды 0,2 см3 разведённой соляной кислоты, 2 см3 эфира для наркоза и 2 см3 раствора бихромата калия. Появление синей окраски эфирного слоя после взбалтывания свидетельствует о наличии остатков перекиси водорода на поверхности обработанных объектов.
5.9. Допускается контроль полноты удаления остатков дезинфекционных и моюще-дезинфекционных средств из группы окислителей (дезактин, перекись водорода, хлорантоин) с рабочих поверхностей технологического оборудования, коммуникаций, инвентаря, внутрицеховой тары при помощи индикаторной йодокрахмальной бумаги (ТУ 6-09-3409). Индикаторную йодокрахмальную бумагу смачивают промывочной водой из соответствующего объекта. Изменение цвета индикаторной бумаги до синего или сине-чёрного свидетельствует о наличии остатков дезинфекционных средств из группы окислителей на поверхности объекта.
5.10. Полноту удаления корзолина иД и деконекса 50 ФФ с поверхности объектов контролируют путём определения АДВ (карбонильные группы в составе альдегидов) в последней порции промывочной воды. К 1 см3 последней промывочной воды добавляют 1 см3 раствора гидроксиламина гидрохлорида концентрации (NH2OH•HCl ) = 0,5 моль/ дм3 и 1-2 капли 0,1 % раствора метилового оранжевого (индикатор).Появление красной окраски свидетельствует о наличии остатков корзолина иД или деконекса 50 ФФ на поверхности объекта.
5.11. Контроль качества дезинфекции поверхностей помещения, технологического оборудования, подготовки одежды для персонала, обработки рук персонала и подготовки материалов для первичной упаковки приведены в соответствующих Методических рекомендациях относительно контроля микробиологической чистоты поверхностей производственных помещений, Методических рекомендациях относительно контроля микробиологической чистоты технологического оборудования, Методических рекомендациях относительно контроля микробиологической чистоты одежды персонала, работающего в производственных помещениях, Методических рекомендациях относительно контроля микробиологической чистоты рук персонала, работающего в производственных помещениях, Методических рекомендациях относительно контроля микробиологической чистоты материалов для первичной упаковки, утверждённых приказом МОЗ Украины 14.12.2001 г. № 502 .
5.12. При проведении контроля используют следующие нейтрализаторы: 0, 5 % раствор тиосульфата натрия при использовании дезактина, перекиси водорода и хлорантоина; 0,2 % раствор пиросернистокислого натрия при использовании корзолина иД; 0, 5 % раствор сульфанола при использовании гембара и деконекса 50 ФФ.
5.13. Контроль над соблюдением ГДК в рабочей зоне активно действующих веществ моющих, дезинфекционных и моюще-дезинфекционных средств осуществляют в соответствии с Методичекими указаниями, утверждёнными Министерством охраны здоровья. Периодичность контроля устанавливают в соответствии с требованиями ГОСТ 12.1.005.
5.14. Контроль содержания моющих средств на основе анионных поверхностно-активных веществ в воздухе рабочей зоны выполняют по содержанию анионных поверхностно-активных веществ в соответствии с требованиями МВ №5815-91-88, утв. 10.09.91.
5.15. Контроль содержания щелочных моющих средств в воздухе рабочей зоны выполняют по содержанию аэрозоля едких щелочей (в перерасчёте на едкий натрий) в соответствии с требованиями МВ №5937-91, утв. 10.09.91.
5.16. Контроль содержания дезактина и хлорантоина в воздухе рабочей зоны выполняют по содержанию дихлорантина в соответствии с требованиями МВ № 5233-90, утв. 28.12.90.
5.17. Контроль содержания перекиси водорода в воздухе рабочей зоны выполняют в соответствии с требованиями МВ № 4586-88, утв. 30.08.88.
5.18. Контроль содержания деконекса 50 ФФ, корзолина иД в воздухе рабочей зоны выполняют по содержанию глутарового альдегида в соответствии с требованиями МВ № 3950-85, утв. 05.11.85.
5.19. Контроль содержания спирта этилового в воздухе рабочей зоны выполняют в соответствии с требованиями МВ № 3975-85, утв. 05.11.85.
6. Требования безопасности и средства предостережения при работе с моющими, дезинфекционными и моюще-дезинфекционными средствами
6.1. Технологические операции, связанные с расфасовкой сухих препаратов, приготовлением и использованием рабочих растворов моющих, дезинфекционных и моюще-дезинфекционных средств необходимо выполнять, придерживаясь средств предосторожности, обеспечивающих защиту кожи, слизистой облочки глаз, верхних дыхательных путей - в спецодежде типа ЯТ и ЯЖ в соответствии с требованиями ГОСТ 12.4.103, и респираторе в соответствии с требованиями ГОСТ12.4.121, в защитных очках типа ПО-2 , ПО-3 или моноблоке в соответствии с требованиями ГОСТ 12.4.013, защитных перчатках в соответствии с требоваиями ГОСТ 20010. Рекомендуется использовать специальные мази и кремы для защиты кожи рук в соответствии с требованиями ГОСТ 12.4.068.
6.2. В производственных помещениях должны придерживаться гигиенических нормативов допустимого содержания в воздухе использующихся моющих, дезинфекционных и моюще-дезинфекционных средств, которые используются: ориентировочный безопасный уровень влияния в воздухе рабочей зоны (ОБРВ р.з.) анионных поверхностно- активных веществ 1,5 мг/м3, предельно допустимая концентрация в рабочей зоне (ГДК р.з.) аэрозоля едких щелочей ( в перерасчёте на едкий натрий) 0,5 мг/м3, ГДК р.з. дихлорантина 0,2 мг/м3 (при работе с хлорантоином), ГДК р.з. глутарового альдегида - 5 мг/м3 (при работе с деконексом 50 ФФ, корзолином иД), ГДК р.з. перекиси водорода - 1,4 мг/м3 (рекомендовано), ГДК р.з. спирта этилового 1000 мг/м3 .
6.3. Помещения для хранения спирта этилового по пожарной безопасности относятся к категории А в соответствии с ОНТП 24. Оборудование, коммуникации и ёмкости, применяемые для хранения и расфасовки спирта этилового, должны быть герметичными и заземлёнными от статического электричества в соответствии с ГОСТ 12.1.018. Электрооборудование должно быть во взрывоопасном исполнении в соответствии с ГОСТ 12.2.020.
Во время работы со спиртом этиловым должны применяться герметические аппараты, оборудование и герметическая транспортная тара.
Резервуары, технологическое оборудование, трубопроводы и сливно-наливные устройства, используемые с целью приёма, хранения и перемещения спирта этилового, должны быть защищены от статического электричества в соответствии с "Правилами защиты от статического электричества в производствах химической, нефтехимической и нефтеперерабатывающей промышленности", утверждёнными 31.01.72 г.
Защитное заземление от статического электричества объединяют, как правило, с заземлением электрооборудования. Величина опоры устройства для заземления, предназначенного для защиты от статического электричества, не должна превышать 100 Ом.
Производственное оборудование и технологические трубопроводы с температурой теплоносителя выше 45º С, размещённые в зоне обслуживания, должны иметь теплоизоляцию, выполненную в соответствии с "Правилами технической эксплуатации теплоиспользующих установок и тепловых сетей " и "Правилами техники безопасности при эксплуатации теплоиспользующих установок и тепловых сетей ", утверждённых 15.06.72 г. Госэнергонадзором.
6.4. Запрещается курить, употреблять пищу, пить во время проведения работ по санитарной обработке объектов химико-фармацевтического производства. После завершения работы лицо и руки необходимо вымыть водой с мылом.
6.5. При случайном попадании моющих, дезинфекционных и моюще-дезинфекционных средств в глаза необходимо промыть их проточной водой на протяжении 10-15 мин. И обратиться за помощью к врачу.
6.6. При случайном попадании моющих, дезинфекционных и моюще-дезинфекционных средств внутрь необходимо промыть желудок водой (выпить несколько стаканов воды) и обратиться за помощью к врачу.
6.7. При поражении дыхательных путей необходимо вывести пострадавшего на свежий воздух или в хорошо проветриваемое помещение, обеспечить покой, тепло и освободить от тесной одежды. Показано употребление молока.
7. Требования охраны окружающей природной среды
7.1. Компоненты моющих, дезинфекционных и моюще-дезинфекционных средств в установленном порядке должны быть пронормированы в воздухе рабочей зоны, атмосферном воздухе населённых мест, воде водных объектов хозяйственно-питьевого и культурно-бытового водоиспользования.
Запрещается использовать моющие, дезинфекционные и моюще-дезинфекционные средства, компоненты которых не имеют гигиенических нормативов в указанных выше объектах окружающей среды.
7.2 Контроль над выбросами вредных веществ в атмосферу осуществляют в соответствии с требованиями ГСП-201-97 «Государственные санитарные правила охраны атмосферного воздуха населенных городов (от загрязнения химическими и биологическими веществами)».
7.3 Охрану почвы от загрязнения промышленными и бытовыми отходами осуществляют согласно требованиям СанПин 42-128-4690-88.
Таблица 1. Расчеты для приготовления растворов моющих, дезинфекционных и моще-дезинфекционных средств
| Концентрация, |
Объем раствора, л |
|||||
| 1.0 |
10.0 |
100.0 |
||||
| Количество |
Объем |
Количество |
Объем |
Количество |
Объем |
|
| 0.1 |
1.0 |
999.0 |
10.0 |
9990.0 |
100.0 |
99900.0 |
| 0.2 |
2.0 |
998.0 |
20.0 |
9980.0 |
200.0 |
99800.0 |
| 0.5 |
5.0 |
995.0 |
50.0 |
9950.0 |
500.0 |
99500.0 |
| 0.75 |
7.5 |
992.0 |
75.0 |
9925.0 |
750.0 |
99250.0 |
| 1.0 |
10.0 |
990.0 |
100.0 |
9900.0 |
1000.0 |
99000.0 |
| 1.5 |
15.0 |
985.0 |
150.0 |
9850.0 |
1500.0 |
98500.0 |
| 2.0 |
20.0 |
980.0 |
200.0 |
9800.0 |
2000.0 |
98000.0 |
| 2.5 |
25.0 |
975.0 |
250.0 |
9750.0 |
2500.0 |
97500.0 |
| 3.0 |
30.0 |
970.0 |
300.0 |
9700.0 |
3000.0 |
97000.0 |
| 4.0 |
40.0 |
960.0 |
400.0 |
9600.0 |
4000.0 |
96000.0 |
| 5.0 |
50.0 |
950.0 |
500.0 |
9500.0 |
5000.0 |
95000.0 |
| 6.0 |
60.0 |
940.0 |
600.0 |
9400.0 |
6000.0 |
94000.0 |
| 7.0 |
70.0 |
930.0 |
700.0 |
9300.0 |
7000.0 |
93000.0 |
| 8.0 |
80.0 |
920.0 |
800.0 |
9200.0 |
8000.0 |
92000.0 |
| 9.0 |
90.0 |
910.0 |
900.0 |
9100.0 |
9000.0 |
91000.0 |
| 10.0 |
100.0 |
900.0 |
1000.0 |
9000.0 |
10000.0 |
90000.0 |
Таблица 2. Расчеты для приготовления растворов ТЕА-АБСК
| Массовая доля ПАР, |
Количество ТЕА-АБСК (г) для приготовления 1 л раствора |
|||||
| Массовая доля ПАР в составе ТЕА-АБСК, % |
||||||
| 35 |
40 |
45 |
||||
| 0.1 |
2.0 |
2.5 |
2.2 |
|||
| 0.5 |
14.25 |
12.5 |
11.1 |
|||
| 1.0 |
28.5 |
25.0 |
22.2 |
|||
| 1.5 |
42.85 |
37.5 |
33.3 |
|||
| 2.0 |
57.2 |
50.0 |
44.5 |
|||
| 3.0 |
87.7 |
75.0 |
66.7 |
|||
| 4.0 |
114.3 |
100.0 |
88.9 |
|||
| 5.0 |
142.8 |
125.0 |
111.1 |
|||
| 6.0 |
171.5 |
150.0 |
133.4 |
|||
| 7.0 |
200.0 |
175.0 |
155.6 |
|||
| 8.0 |
229.0 |
200.0 |
177.8 |
|||
| 9.0 |
257.0 |
225.0 |
200.0 |
|||
| 10.0 |
286.0 |
250.0 |
222.0 |
|||
Таблица 3. Расчеты для приготовления растворов рецептуры С-4
| Объем раствора, л |
Объемы ингредиентов |
|||
| Пероксид водорода (массовая доля 30%), мл |
Муравьиная кислота |
Вода очищенная, л |
||
| Массовая доля 100%, мл |
Массовая доля 85%, мл |
|||
| 1 2 5 10 |
17.1 34.2 85.5 171.0 |
6.9 13.8 34.5 69.0 |
8.1 16.2 40.5 81.0 |
до 1.0 до 2.0 до 5.0 до 10.0 |
Таблица 4. Рекомендации по применению моющих, дезинфицирующих и моюще- дезинфицирующих средств с учетом коррозийной устойчивости материалов
| Название средства |
Нержавеющая сталь, стекло, эмаль, кафель |
Чорный металл с антикоррозийным покрытием |
Алюминий |
| Каустическая сода |
+ |
+ |
- |
| Кальцинированная сода |
+ |
+ |
- |
| Средство моющее техническое синтетическое типа А,Б, В |
+ |
+ |
+ |
| Биомой |
+ |
+ |
+ |
| Кислотные моющие средства (азотная, фосфорная, соляная, уксусная, сульфаминовая кислоты) |
+ |
- |
+ |
| Гембар |
+ |
+ |
+ |
| Деконекс ФФ |
+ |
+ |
- |
| Корзолин иД |
+ |
+ |
- |
| Перекись водорода |
+ |
- |
+ |
| Дезактин |
+ |
+ |
+ |
| Хлорантоин |
+ |
+ |
+ |
Примечание: «+» - средство допускается для обработки объекта;
«-» - средство не допускается для обработки объекта.
Таблица 5. Рекомендации по применению моющих средств
| № |
Название средства |
Концентрация |
Применение |
| 1. |
Кальцинированная сода |
0.5 12 |
Мытье оборудования, инвентаря, тары ручным способом Мытье технологического оборудования и коммуникаций циркуляционным способом |
| 2. |
Каустическая сода |
0.5 1-2 |
Мытье оборудования, инвентаря, тары ручным способом Мытье технологического оборудования и коммуникаций циркуляционным способом |
| 3. |
Средство моющее техническое синтетическое типа А, Б, В |
0.5 1.0 |
Мытье оборудования, инвентаря, тары ручным способом Мытье технологического оборудования, коммуникаций и инвентаря циркуляционным способом |
| 4. |
Биомой |
0.5 0.15-0.3 |
Мытье оборудования, инвентаря, тары ручным способом Мытье технологического оборудования и коммуникаций циркуляционным способом |
| 5. |
ТЕА-АБСК |
0.1-10.0 |
Мытье технологического оборудования и инвентаря |
| 6. |
Азотная, фосфорная, соляная, уксусная, сульфаминовая кислоты |
Удаление осадков в трубопроводе |
Таблица 6. Режимы текущей дезинфекции поверхностей помещений, уборочного инвентаря и оборудования
| Название средства |
Фирма производитель |
Активно действующие вещества |
Форма выпуска |
Концентрация, % (по препарату) |
Экспозиция, мин |
| Гембар |
НВП «Биоцид» (Украина) |
Полидекаметилен-гуанидин |
Раствор |
5.0 |
120 |
| Деконекс ФФ |
“Borer Chemie AG» (Швейцария) |
Глутаровый альдегид Глиоксаль Четвертинные и амонийные соединения |
Раствор |
0.25 0.5 |
60 30 |
| Дезактин |
ООО «ДЕЛАНА» (Украина) |
1,3-дихлор-5,5-диметилгидантоин |
Порошок |
0.2 |
30 |
| Хлорантоин |
НВО «Фармакос» (Украина) |
1,3-дихлор-5,5-диметилгидантоин |
Порошок |
0.2 |
30 |
Таблица 7. Режимы текущей дезинфекции технологического оборудования и коммуникаций
| Название средства |
Фирма производитель |
Активно действующие вещества |
Форма выпуска |
Концентрация, % (по препарату) |
Экспозиция, мин |
| Дезактин |
ООО «ДЕЛАНА» (Украина) |
1,3-дихлор-5,5-диметилгидантоин |
Порошок |
0.2 |
30 |
| Деконекс ФФ |
“Borer Chemie AG» (Швейцария) |
Глутаровый альдегид Глиоксаль Четвертинные и амонийные соединения |
Раствор |
0.5 1.0 |
60 30 |
| Пероксид водорода |
Украина |
Пероксид водорода |
Раствор |
1.0* 3.0 4.0 6.0 |
60 60 60 60 |
| Хлорантоин |
НВТ «Фармакос» (Украина) |
1,3-дихлор-5,5-диметилгидантоин |
Порошок, таблетки |
0.2 |
30 |
| Спирт этиловый |
Украина |
Этанол |
Раствор |
76 |
60 |
Примечание: * Концентрации приведены по АДР.
Таблица 8. Режимы профилактической дезинфекции инвентаря, инструментов и внутреннецеховой тары
| Название средства |
Фирма производитель |
Активно действующие вещества |
Форма выпуска |
Концентрация, % (по препарату) |
Экспозиция, мин |
| Деконекс ФФ |
“Borer Chemie AG» (Швейцария) |
Глутаровый альдегид Глиоксаль Четвертинные и амонийные соединения |
Раствор |
0.5 1.0 |
60 30 |
| Корзолин иД |
“Bode Chemie GmbH» (Германия) |
Глутаровый альдегид |
Раствор |
4.0 10.0 |
150 60 |
| Пероксид водорода |
Украина |
Пероксид водорода |
Раствор |
6.0* |
60 |
| Дезактин |
ООО «ДЕЛАНА» (Украина) |
1,3-дихлор-5,5-диметилгидантоин |
Порошок |
0.2 |
30 |
| Хлорантоин |
НВТ«Фармакос» (Украина) |
1,3-дихлор-5,5-диметилгидантоин |
Порошок, таблетки |
0.2 |
30 |
Таблица 9. Режимы текущей дезинфекции технологического оборудования и коммуникаций, которые контаминированы плесневыми грибами
| Наименование дезинфекционного средства |
Фирма изготовитель |
Активно действующие вещества |
Форма выпуска |
Концентрация, % (по препарату) |
Экспозиция, мин. |
Пероксид водорода |
Украина |
Пероксид водорода |
Раствор |
4.0* |
60 |
Дезактин |
ООО «Делана» (Украина) |
1.3-дихлор- 5.5-диметил- гидантоин |
Порошок |
2.0 |
60 |
| Хлорантоин |
НВТ «Фармакос» (Украина) |
1.3-дихлор- 5.5-диметил- гидантоин |
Порошок, таблетки |
2.0 |
60 |
Таблица 10. Режимы профилактической дезинфекции поверхностей помещений, что контаминированы плесневыми грибами
| Наименование дезинфекционного средства |
Фирма изготовитель |
Активно действующие вещества |
Форма выпуска |
Концентрация, % (по препарату) |
Экспозиция, мин. |
Дезактин |
ООО «Делана» (Украина) |
1.3-дихлор- 5.5-диметил- гидантоин |
Порошок |
2.0 |
60 |
| Хлорантоин |
НВТ «Фармакос» (Украина) |
1.3-дихлор- 5.5-диметил- гидантоин |
Порошок, таблетки |
2.0 |
60 |
Таблица 11. Режимы профилактической дезинфекции поверхностей помещений, что контаминованы Mycobacterium tuberculosis
| Наименование средства |
Фирма изготовитель |
Активно действующие вещества |
Форма выпуска |
Концентрация, % (по препарату) |
Экспозиция, мин. |
Дезактин |
ООО «Делана» (Украина) |
1.3-дихлор- 5.5-диметил- гидантоин |
Порошок |
1.0 |
60 |
Деконекс 50 ФФ |
«Borer Chemie AG» (Швейцария) |
Глутаровый альдегит Глиоксаль Четвертинные амонийные соединения |
Раствор |
1.5 |
60 |
| Хлорантоин |
НВТ «Фармакос» (Украина) |
1.3-дихлор- 5.5-диметил- гидантоин |
Порошок, таблетки |
1.0 |
60 |
Директор ГНЦЛС,
Академик МИА В.П. Георгиевский
УТВЕРЖДЕНО
Приказ МОЗ Украины
14.12. 2001 г. № 502
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ОТНОСИТЕЛЬНО ПОСТУПЛЕНИЯ ИСХОДНОГО СЫРЬЯ
И МАТЕРИАЛОВ ДЛЯ ПЕРВИЧНОЙ УПАКОВКИ НА СКЛАД
ПРЕДПРИЯТИЯ И В ПРОИЗВОДСТВО НЕСТЕРИЛЬНЫХ
ЛЕКАРСТВЕННЫХ СРЕДСТВ
1.Основные положения
1.1. Эти методические рекомендации предлагают порядок исполнения санитарно - гигиенических мероприятий при поступлении исходного сырья и материалов для первичной упаковки на склад предприятия и в производство нестерильных лекарственных средств.
1.2. Как исходное сырьё надо понимать все вещества определённого качества, используемые в производстве лекарственных средств, за исключением материалов для упаковки, моющих, дезинфекционных и моюще-дезинфекционных средств.
1.3. Как материалы для первичной упаковки нужно понимать материалы, непосредственно контактирующие с расфасованными в них лекарственными средствами.
1.4. Исходное сырьё (далее "сырьё") и материалы для первичной упаковки (далее "материалы") должны поступать на предприятие в упаковке или таре, соответствующей нормативной документации, соответствовать требованиям действующих стандартов или техническим условиям и иметь сертификаты или свидетельства качества. Упаковка должна обеспечивать хранение и предупреждение от возможного повторного загрязнения сырья и материалов на протяжении всего срока их годности.
2. Порядок поступления сырья и материалов на склад предприятия
2.1. Разгрузка сырья и материалов, поступающих на предприятие должна проводиться в пункте приёма (зоне) помещения склада (складов), защищённом от воздействия атмосферных осадков. Категорически запрещается проводить разгрузку на открытых площадках, непосредственно на землю, снег, мокрые или покрытые снегом настилы.
2.2. Пункт приёма (зону) необходимо содержать в чистоте: регулярно очищать от мусора, пыли, проводить влажную уборку.
2.3. После разгрузки сырья и материалов их транспортную упаковку, при необходимости, нужно очистить (при помощи механической или влажной очистки) или провести дезинфекционную обработку. При этом нужно внимательно осмотреть каждую упаковку с целью проверки её целостности.
На каждую упаковку сырья и материалов прикрепляют этикетки, на которых указывают информацию в соответствии с требованиями соответствующих письменных инструкций или стандартных рабочих процедур.
2.4. После очищения и дезинфекционной обработки транспортной упаковки в помещении склада производят отбор проб сырья или материалов, не подлежащих специальной подготовке (например, контурная ячеечная упаковка из плёнки поливинилхлоридной и фольги алюминиевой печатной лаковой, или контурная безъячеечная упаковка из бумаги с полиэтиленовым покрытием, или из бумаги с полимерным покрытием, или фольги ламинированной и т.д.) в специально предназначенной зоне (боксе) или помещении.
2.5 Бокс (помещение) должен быть оборудован подачей ламинарного или вентиляторного потока воздуха, очищенного от частиц и микроорганизмов, с целью предупреждения повторного загрязнения сырья и материалов в зоне открытой продукции.
2.6 В боксе (помещении) упаковку раскрывают с соблюдением правил асептики, потом проводят отбор проб для идентификации и входного контроля сырья и материалов. Отбор проб необходимо проводить в соответствии с КД 64У-2-95 "Входной контроль сырья и материалов для производства продукции медицинской и микробиологической промышленности".
2.7 Посуда и вспомогательные инструменты, используемые для отбора проб сырья и материалов, должны быть стерильными.
2.8 После отбора проб в боксе (помещении) восстанавливают первичную и вторичную упаковку, потом всю серию (партию) сырья или материалов, от которой отобраны пробы, передают в карантинную зону склада для хранения на период проведения их входного контроля в отделе контроля качества.
2.9 На этикетках упаковок, с которых были отобраны пробы, делают отметки. В процессе прохождения разных стадий контроля ив зависимости от его результатов (например, разрешено к использованию в производстве или забраковано) на упаковках производят замену этикеток и направляют сырьё или материалы в соответствующую зону хранения. Целесообразно в каждой зоне хранения использовать этикетки определённого цвета.
2.10 Для предупреждения перекрёстного загрязнения не допускается проведение одновременного отбора проб разных серий (партий) одного наименования или разных наименований сырья или материалов.
2.11 Отобранные образцы сырья и материалов маркируют в соответствии с требованиями соответствующих письменных инструкций или стандартных рабочих процедур , потом передают на контроль в отдел контроля качества.
2.12 После подтверждения идентичности и соответствия требованиям аналитической нормативной или нормативной документации сырьё и материалы передают в зону склада, в которой хранится продукция, разрешённая к использованию на производстве.
2.13 В случае несоответствия сырья или материалов требованиям аналитической нормативной или нормативной документации принимается решение об их забраковке. Забракованную продукцию направляют в изолятор хранения брака.
3.Порядок поступления сырья в производство
3.1. Сырьё, разрешённое к использованию в производстве готовых лекарственных средств, должно поступать в производственное помещение через пропускник для приёма сырья.
3.2. Пропускник должен иметь систему блокирования одновременного открывания дверей в двух соседних зонах. Свободный переход рабочего персонала в этом помещении не разрешается.
3.3. Санитарно-гигиеническая подготовка пропускника должна соответствовать той, которая применяется в прилегающей к нему зоне с более высокой степенью чистоты.
3.4. Транспортировка сырья должна производиться на специальных тележках, изготовленных из хромированной или никелированной стали, или крепких полимерных материалов, легко поддающихся мытью и дезинфекционной обработке. Не допускается использование тележек из зон менее чистых в зонах с более высокой степенью чистоты без дополнительного очищения и дезинфекционной обработки.
3.5. В помещении приёма сырья его освобождают от вторичной упаковки, потом в первичной упаковке передают в помещение для взвешивания. При необходимости может быть проведена дезинфекционная обработка первичной упаковки.
3.6. Взвешивание сырья проводят в чистой ёмкости с крышками, изготовленными из нержавеющей стали или полимерных материалов.
3.7. В закрытых ёмкостях сырьё поступает на следующую технологическую операцию в производственное помещение в соответствии с технологической схемой производства.
3.8. В том случае, если сырьё полностью не используют, его в первичной упаковке передают в помещение приёма сырья, помещают во вторичную упаковку, восстанавливают обе упаковки и возвращают на склад. Хранение сырья в помещения для взвешивания и приёма сырья не разрешается.
4. Порядок поступления материалов для первичной упаковки в производство
4.1. В производстве лекарственных средств необходимо использовать материалы с учётом очерёдности их поступления или подготовки.
4.2. Подготовку материалов, требующих дополнительной обработки (мытья, сушки, термической обработки) необходимо проводить в соответствии с требованиями Методических рекомендаций относительно подготовки материалов для первичной упаковки, утверждённых приказом МОЗ Украины 14.12.2001г. №502.
4.3. Материалы, срок годности которых вышел, должны быть уничтожены или возвращены для повторной обработки, о чём составляется соответствующий протокол.
4.4. При поступлении в производство материалы должны быть проверены относительно количества, идентичности, микробиологической чистоты и соответствия нормативной документации на упаковке.
4.5. Поступление материалов со склада в зону упаковки готовой продукции должно проводиться через пропускник, в соответствии с поступлением исходного сырья в производство. Транспортировку материалов необходимо проводить в чистых, закрытых устройствах, приспособлениях или контейнерах, исключающих возможность вторичного загрязнения. Поступившие материалы необходимо разместить на металлических поддонах. Категорически запрещается разгрузка контейнеров непосредственно на пол.
В производстве необходимо свести к минимуму риск повторного загрязнения, смешивания или подмены материалов для первичной упаковки.
4.6. После завершения процесса упаковки все неиспользованные материалы, на которых проставлен номер серии, должны быть уничтожены, о чём составляется соответствующий протокол. Материалы, не содержащие обозначения серии и срока годности, должны быть возвращены на склад или на дополнительную обработку в установленном порядке.
Директор ДНЦЛЗ,
академик МИА В.П. Георгиевский.
УТВЕРЖДЕНО
Приказ МОЗ Украины
14.12.2001г. №502
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ОТНОСИТЕЛТНО ПОРЯДКА ХРАНЕНИЯ ИСХОДНОГО СЫРЬЯ
И МАТЕРИАЛОВ ДЛЯ ПЕРВИЧНОЙ УПАКОВКИ
1. Общие положения
1.1. В этих методических рекомендациях приведены требования к складским помещениям и условиям хранения исходного сырья (далее "сырья") и материалов для первичной упаковки (далее "материалов") на предприятиях, выпускающих нестерильные лекарственные средства.
1.2. Сырьё и материалы нужно хранить в помещениях, изолированных от основного производства и с учётом исключения возможности их смешивания или загрязнения.
1.3. Хранение сырья и материалов в складских помещениях необходимо производить в соответствии с требованиями аналитической нормативной или нормативной документации на каждый вид продукции.
1.4. Выдачу сырья и материалов в производство проводят с учётом очерёдности поступления их на склад предприятия и срока годности.
2. Требования к складским помещениям
2.1. Устройство, оборудование и эксплуатация складских помещений должны обеспечивать должные условия хранения сырья и материалов, использующихся в производстве нестерильных лекарственных средств.
2.2. Складские помещения должны иметь достаточную площадь для упорядоченного хранения продукции в необходимом количестве, удобного и безопасного передвижения персонала, грузов, транспортных средств, а также простоту и лёгкость уборки.
2.3. Складские помещения должны быть сухими и чистыми, а также обеспеченными необходимым количеством металлических стеллажей и поддонов.
Установку стеллажей и поддонов в штабелях осуществляют таким способом, чтобы они находились на расстоянии не менее 6 м от внешних стен , верхняя полка стеллажа (поддона) - не менее 1,0 м от потолка, а нижняя полка стеллажа (поддона) - не менее 0,25 м от пола. Расстояние между стеллажами и поддонами в штабелях должно быть не меньше 0, 75 м. При использовании грузоподъёмных механизмов для погрузочно-разгрузочных работ, расстояние между стеллажами и поддонами в штабелях необходимо определить с учётом использования конкретного механизма.
Каждый стеллаж должен иметь постоянную маркировку, а также место для хранения - индивидуальный номер.
2.4. Складские помещения должны быть оборудованы приточно-вытяжной вентиляцией воздуха с механическим принуждением в соответствии с действующей нормативно-технической документацией (БНиП, методических рекомендаций , отраслевой нормативной документации и т.д.).
2.5. Складские помещения должны иметь отдельную зону для приёма, очищения и ,при необходимости, дезинфекционной обработки транспортной упаковки сырья или материалов, поступающих на склад, и зону для их выдачи. Эти зоны должны быть спроектированы и оборудованы так, чтобы продукция была защищена от воздействия неблагоприятных погодных и климатических условий.
2.6. Для отбора сырья, поступающего на предприятие, складские помещения должны иметь зону (бокс), оборудованную подачей ламинарного потока воздуха или вентиляционного воздуха, очищенного от частиц и микроорганизмов, если предприятие не имеет для этого отдельного , специально оборудованного помещения.
2.7. Хранение пожаро- и взрывоопасных веществ необходимо осуществлять в специально оборудованных для этого помещениях.
2.8. Складские помещения для хранения пожаро- и взрывоопасных веществ должны быть сухими и чистыми, защищёнными от прямых солнечных лучей. Пусковое устройство для приточно-вытяжной вентиляции должно размещаться снаружи. Вентиляционное оборудование должно быть пожароопасным, а электрооборудование и освещение произведено во взрывоопасном варианте в соответствии с правилами устройства электроустановок. В помещении, где хранятся легковоспламеняющиеся жидкости, должны быть установлены газоанализаторы взрывоопасных концентраций топливных газов.
2.9. Температурный режим в складских помещениях должен содержаться на уровне (20±2)ºС, относительная влажность воздуха от 35 до 60 % (если нет других требований к условиям хранения сырья и материалов в аналитической нормативной или нормативной документации). Для наблюдения за этими параметрами складские помещения необходимо оборудовать термометрами и гигрометрами, которые крепятся на внутренних стенах вдали от нагревательных приборов на высоте (1,5 - 1,7 ) м от пола и на расстоянии не меньше 3 м от дверей. В тех случаях, когда нужна более низкая температура хранения, вещества необходимо хранить в морозильных камерах.
2.10. Не допускается обогрев помещений газовыми приборами с открытым пламенем или электрообогревательными приборами с открытой спиралью.
2.11. Внутренние поверхности складских помещений (пол, стены, потолок) и двери должны быть изготовлены из материала или покрыты материалом, легко поддающимся очищению, а при необходимости, дезинфекционной обработке. Пол должен иметь твёрдое, ровное покрытие, исключающее щели, выбоины или другие неровности, иметь достаточную твёрдость и выдерживать нагрузку от хранящихся материалов и движущихся механизмов.
2.12. Складские помещения должны быть надёжно защищены от проникновения мошек и грызунов. Все предприятия по производству лекарственных средств должны иметь договор с местными органами санитарного надзора на проведение мероприятий борьбы с мошкой и грызунами.
2.13. В складских помещениях необходимо проводить влажную уборку пола каждый день и немедленно при каких-нибудь загрязнениях , возникших при погрузочно-разгрузочных работах Не реже одного раза в полгода проводят генеральную уборку складских помещений : проводят очищение и влажную уборку воздуховодов, потолка, стен, окон, дверей, а потом моют пол. Обработку стеллажей и поддонов проводят после того, как из них уберут сырьё или материалы. Дезинфекционную обработку помещений проводят с помощью микробиолога отдела контроля качества.
2.14. Персонал, работающий на складе, должен быть одет в чистую одежду(халат или штаны и куртку, шапочку, а при необходимости маску, перчатки, передник и т.д.). и сменную обувь. По мере загрязнения , но не реже одного раза в неделю, необходимо осуществлять стирку и утюжить одежду.
2.15. Перед входом в помещение склада должны быть приспособления для очищения и дезинфекции обуви.
2.16. Помещения склада должны быть оборудованы охранной и пожарной сигнализацией.
2.17. Не допускается пребывание посторонних в помещении склада.
3. Требования к условиям хранения сырья и материалов
3.1. Сырьё и материалы нужно размещать на стеллажах отдельно, согласно наименованиям, учитывая наиболее полное использование площади, возможности применения автопогрузок и обеспечения санитарного порядка. При необходимости допускается хранение их в транспортной таре на поддонах.
3.2. Склады должны иметь отдельные зоны или помещения для хранения сырья, полупродуктов и материалов для первичной упаковки, находящихся в карантине, разрешённых к использованию или забракованных.
Складские помещения должны быть размещены так, чтобы не нарушался поток технологического процесса.
3.3. Продукция, размещённая на складе, должна быть соответствующим образом маркирована. Маркировка должна быть чёткой, недвузначной, выполняться в принятом на предприятии формате и включать следующую информацию: название, статус(карантин, проверка, полученное разрешение, брак, возвращение и т.д.), внутренний код или номер серии, срок годности. Уместно использование цветной маркировки, обозначающей статус продукции. Доступ к продукции должен быть ограничен только для уполномоченного персоналом.
3.4. Печатные материалы для упаковки (этикетки, маркированные материалы для первичной упаковки), с помощью которых идентифицируется продукция для потребителя, нужно хранить в отдельном помещении (зоне), исключающем несанкционированный доступ к ним. Нужно принять все необходимые меры для предотвращения возможного их смешивания и ошибочного использования при производстве лекарственных средств. Для хранения и транспортировки рекомендуется использовать закрытые контейнеры.
3.5. Порядок хранения сырья и материалов должен соответствовать типовым правилам пожарной безопасности для промышленных предприятий.
3.6. При размещении продукции необходимо учитывать агрегатное состояние веществ (отдельно хранить жидкие, сыпучие, газообразные), их физико-химические свойства, влияние других факторов окружающей среды, а также срок хранения.
3.7. Ядовитые, сильнодействующие, наркотические вещества и лекарственные средства следует хранить в безопасных и охраняющихся помещениях в соответствии с действующей инструкцией хранения, учёта, отпуска и транспортировки ядовитых, сильнодействующих и наркотических веществ.
3.8. Хранение пожаро- и взрывоопасных веществ нужно осуществлять в отдельных специализированных складах, целиком отвечающих действующим Отраслевым нормам технологического проектирования (ОНТП). Стеллажи должны иметь отбортовки высотой не меньше 0,25 м, ширину - не больше 1,0 м. Расстояние между стеллажами должно быть не меньше 1,15 м. При использовании грузоподъёмных механизмов для погрузочно-разгрузочных работ, расстояние между стеллажами необходимо вычислить с учётом использования конкретного механизма.
Не допускается совместное хранение веществ, которые при контакте могут создавать угрозу возникновения пожара или взрыва, а также при возгорании которых нельзя использовать одинаковые средства погашения.
3.9. Легковоспламеняющиеся жидкости в количестве более 100 кг нужно хранить в отдельно размещённом строении, в стеклянной или металлической таре, изолированно от помещений для хранения огнеопасных веществ других групп.
3.10. Вещества, требующие защиты от воздействия света, нужно хранить в таре из светозащитного материала, в тёмном помещении или шкафах, окрашенных внутри в чёрный цвет, с плотно прилегающими дверцами или в плотно сколоченных ящиках с плотно прилегающей крышкой.
3.11. Вещества, требующие защиты от влаги, испарения (например, эфирные масла, жидкие спиртовые концентраты и т.п.), воздействия повышенной температуры, воздействия газов с выраженными гигроскопическими свойствами, кристаллогидраты и легкоокисляемые кислородом воздуха, необходимо хранить отдельно по наименованиям в упаковке и условиях, предусмотренных аналитической нормативной документацией.
3.12. Душистые вещества нужно хранить изолированно в герметической таре, через которую не должны проникать запахи, и отдельно по наименованиям.
3.13. Окрашенные вещества нужно хранить в специальном шкафу в плотно закупоренной упаковке , отдельно по наименованиям. При работе с окрашенными веществами для каждого наименования нужна отдельная посуда и инвентарь.
3.14. Кислоты и щёлочи нужно хранить в герметически закрытой упаковке в отдельном помещении, оборудованном приточно-вытяжной вентиляцией, на металлических стеллажах или поддонах с отбортовкой.
3.15. Вспомогательные вещества(сахар, крахмал, муку и другое питательное сырьё) нужно хранить в промышленной упаковке, отдельно по наименованиям.
4.Хранение лекарственного растительного сырья
4.1. Лекарственное растительное сырьё (далее "сырьё") должно храниться в соответствиии с требованиями аналитической нормативной документации.
4.2. Помещения для хранения сырья должны содержаться в чистоте, быть сухими, хорошо проветриваться и быть оборудованными приспособлениями , препятствующими проникновению мошек и грызунов. Необходимо проводить мероприятия по борьбе с мошкой и грызунами в случае проникновения их вместе с сырьём.
4.3. При поступлении сырья на склад предприятия необходимо внимательно осмотреть каждую упаковку. В случае нарушения целостности упаковки в период транспортировки должно быть принято решение о её восстановлении или замене, или забраковке такого сырья. Забракованное сырьё отправляют в зону хранения брака.
4.4. При размещении и хранении сырья нужно принимать меры против перекрёстного их загрязнения.
4.5. Складывание сырья нужно проводить на стеллажах с высотой укладки штабелей не больше 2,5 м для ягод, плодов, семян , почек и не больше 4,0 м для всего остального сырья отдельно согласно наименованиям. Нижняя полка стеллажа должна находиться на расстоянии не меньше 0,15 м от пола. Штабеля размещают на расстоянии от стен не меньше 0,25 м , между штабелями - не меньше 0,5 м. Центральный проход должен иметь ширину не меньше 2,0 м, расстояние между стеллажами - не меньше 1,0 м. Размещение штабелей на стеллажах не должно препятствовать свободной циркуляции воздуха. На каждом штабеле должна быть прикреплена этикетка в соответствующем цветном исполнении, указывающем на статус сырья(карантин, разрешено к производству, брак и др.). Маркировка на этикетках должна содержать информацию в соответствии с требованиями соответствующих письменных инструкций или стандартных рабочих процедур.
4.6. При использовании автопогрузчиков для погрузочно-разгрузочных работ ширину центрального прохода и расстояние между стеллажами необходимо определять с учётом использования механизмов.
4.7. Лекарственное сырьё, содержащее эфирные масла, нужно хранить в изолированном помещении.
4.8. Ядовитое и наркотическое лекарственное сырьё необходимо хранить в отдельном помещении, обеспеченном охранной сигнализацией, в соответствии с требованиями хранения наркотических и отравляющих веществ.
4.9. Необходимо периодически проводить внешний осмотр лекарственного сырья. При изменении окраски или появлении нетипичного запаха для осматриваемого сырья или каких-нибудь других изменений нужно его изолировать от основного сырья и сделать контроль по основным показателям качества. Забракованное сырьё нужно удалить в зону хранения брака. В случае несоответствия качества сырья по микробиологическим показателям, зону его хранения нужно тщательно очистить и провести дезинфекционную обработку.
Директор ДНЦЗЛ,
академик МИА В.П. Георгиевский.
|
|

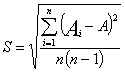 ,
,